Написание координационных формул солей и определение координационного числа металла
Задача 716.
Из раствора комплексной соли PtCl4 . 6NH3 нитрат серебра осаждает весь хлор в виде хлорида серебра, а из раствора соли PtCl4 . 3NH3 - только 1/4 часть входящего в ее состав хлора. Написать координационные формулы этих солей, определить координационное число платины в каждой из них.
Решение:
а) Отсутствие в растворе соли PtCl4 . 6NH3 ионов Pt4+ и свободного аммиака означает, что эти компоненты входят во внутреннюю сферу комплексного соединения. Так как все четыре хлорид-иона осаждаются AgNO3, то состав внутренней сферы комплексного соединения соответствует формуле [Pt(NH3)6]4+. Во внешней сфере находятся четыре хлорид-иона, компенсирующие заряд внутренней сферы, получим формулу комплексного соединения [Pt(NH3)6]Cl4.
Диссоциация комплексного соединения проходит по схеме:
[Pt(NH3)6]Cl4 ⇔ [Pt(NH3)6]4+ + 4Cl-
Координационное число центрального атома показывает общее число  - связей с лигандами. В данном комплексном ионе комплексообразователь Pt4+ связан с шестью нейтральными молекулами NH3, значит, координационное число платины равно 6.
- связей с лигандами. В данном комплексном ионе комплексообразователь Pt4+ связан с шестью нейтральными молекулами NH3, значит, координационное число платины равно 6.
б) Отсутствие в растворе соли PtCl4 . 3NH3 ионов Pt4+ и свободного аммиака означает, что эти компоненты входят во внутреннюю сферу комплексного соединения. Кроме того, во внутреннюю сферу входят три хлорид-иона, не осаждаемые AgCl3. Следовательно, состав внутренней сферы соответствует формуле [Pt(NH3)3Cl3]+. Во внешней сфере находится один хлорид-ион, компенсирующий заряд внутренней сферы комплекса, получим формулу комплексного соединения [Pt(NH3)3Cl3]Cl.
Диссоциация комплексного соединения проходит по схеме:
[Pt(NH3)3Cl3]Cl3 ⇔ [Pt(NH3)3Cl3]3+ + Cl-
Координационное число центрального атома показывает общее число  - связей с лигандами. В данном комплексном ионе комплексообразователь Pt4+ связан с тремя нейтральными молекулами NH3 и тремя хлорид-ионами, значит, координационное число платины равно 6.
- связей с лигандами. В данном комплексном ионе комплексообразователь Pt4+ связан с тремя нейтральными молекулами NH3 и тремя хлорид-ионами, значит, координационное число платины равно 6.
Задача 717.
Известны две комплексные соли кобальта, отвечающие одной и той же эмпирической формуле
CoBrSO4 . 5NH3. Различие между ними проявляется в том, что раствор одной соли дает с ВаСI2 осадок, но не образует осадка с AgNO3, раствор же другой соли, наоборот, дает осадок с AgNO3, но не дает осадка с ВаСI2. Написать координационные формулы обеих солей и уравнения их диссоциации на ноны.
Решение:
а) Так как соль CoBrSO4 . 5NH3 в растворе с ВаСI2 даёт осадок, то это означает, что в растворе присутствуют ионы SO42-, а ионы Br- входят в состав внутренней сферы, потому что не образуется осадок с AgNO3. Следовательно, состав внутренней сферы соответствует формуле [Co(NH3)Br]2+. Во внешней сфере находится ион SO42-, компенсирующий заряд внутренней сферы комплекса [Co(NH3)Br]SO4. Диссоциация комплекса в растворе соли протекает по схеме:
[Co(NH3)Br]SO4 ⇔
⇔ [Co(NH3)Br]2+ + SO42-
б) Так как соль CoBrSO4 . 5NH3 в растворе с ВаСI2 не даёт осадок, то ион SO42- входит в состав внутренней сферы комплексного иона, образование осадка с AgNO3 указывает на то, что бромид-ион входит в состав внешней сферы комплекса, получим формулу комплексного иона: [Co(NH3)SO4]+. Во внешней сфере находится ион Br-, компенсирующий заряд внутренней сферы комплекса [Co(NH3)SO4]Br.
Диссоциация комплекса в растворе протекает по схеме:
[Co(NH3)SO4]Br ⇔
⇔[Co(NH3)SO4]+ + Br-.
Задача 718.
К раствору, содержащему 0,2335 г комплексной соли CoCl3 . 4NH3, добавили в достаточном количестве раствор AgNO3. Масса осажденного АgСI составила 0,1435 г. Определить координационную формулу соли.
Решение:
Согласно закону эквивалентов массы (объёмы) реагирующих веществ m1 и m2 (относятся) прямо пропорциональны их молярным массам (объёмам) эквивалентов:
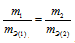
Подставив в данное соотношение массы реагирующих веществ и молярную массу эквивалента хлорида серебра (МЭ(AgNO3) = M/1 = 143,32 г/моль), рассчитаем молярную массу эквивалента комплексного соединения, получим:
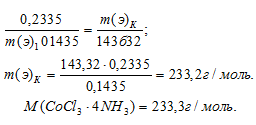
Так как 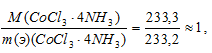 то можно сделать вывод, что раствор AgNO3 осаждает только один эквивалент хлорид-ионов во внешней сфере комплекса. Следовательно, внутренняя сфера соответствует формуле [Co(NH3)4Cl2]+. Во внешней сфере находится один хлорид-ион, компенсирующий заряд внутренней сферы комплекса [Co(NH3)4Cl2]Cl.
то можно сделать вывод, что раствор AgNO3 осаждает только один эквивалент хлорид-ионов во внешней сфере комплекса. Следовательно, внутренняя сфера соответствует формуле [Co(NH3)4Cl2]+. Во внешней сфере находится один хлорид-ион, компенсирующий заряд внутренней сферы комплекса [Co(NH3)4Cl2]Cl.

