Уравнения химических реакций комплексных соединений в молекулярной и ионно-молекулярной форме
Задача 729.
Установить, в каких случаях произойдет взаимодействие между растворами указанных электролитов. Написать уравнения реакций в молекулярной и ионно-молекулярной форме:
а) К2[HgI4] + KBr;
б) К2[HgI4] + KCN;
в) [Ag(NH3)2]Cl + K2S2O3;
г) K[Ag(CN)2] + KBr;
д) K[Ag(CN)2] + NH3;
е) K[Ag(NO2)2] + NH3;
ж) [Ag(NH3)2]Cl + NiCl2;
з) K3[Cu(CN)4] + Hg(NO3)2.
Решение:
а) К2[HgI4] + KBr
Реакция не протекает так как Kн(K2[HgI4]2-) < Kн(K2[HgBr4]2-),
При диссоциации К2[HgI4] и KBr образуются ионы К+, Br- и [HgI4]2-, который обладает большой устойчивостью:
2K+ + [HgI4]2- + K+ + Br- =
= 3K+ + [HgI4]2- + Br- - реакция не протекает.
б) К2[HgI4] + KCN
Реакция протекает так как Kн(K2[HgI4]) > Kн(K2[Hg(CN)4], получим:
K2[HgI4] + 4KCN = K2[Hg(CN)4] + 4KI (молекулярная форма);
2K+ + [HgI4]2- + 4K+ + 4CN— =
= 2K+ + [Hg(CN)4]2- + 4K+ + 4I— (полная ионная форма);
[HgI4]2- + 4CN— = [Hg(CN)4]2- + 4I— (сокращенная ионная форма).
в) [Ag(NH3)2]Cl + K2S2O3
Реакция протекает так как Kн([Ag(NH3)2]+) > Kн([Ag(S2O3)2]3-), получим:
[Ag(NH3)2]Cl + 2K2S2O3 =
= (K3[Ag(S2O3)2] + KCl + 2NH3 (молекулярная форма);
[Ag(NH3)2]+ + Cl- + 4K+ + 2S2O32- =
= 4K+ + [Ag(S2O3)2]3- + Cl— + 2NH3 (полная ионная форма);
[Ag(NH3)2]+ + 2S2O32- =
[Ag(S2O3)2]3- + 2NH3 (сокращенная ионная форма).
г) K[Ag(CN)2] + KBr;
Реакция не протекает так как при диссоциации K[Ag(CN)2] и KBr образуются ионы К+, Br- и [Ag(CN)2]-, который обладает большой устойчивостью.
д) K[Ag(CN)2] + NH3
Реакция не протекает так как Kн([Ag(CN)2]-) < Kн([Ag(NH3)2]+). При диссоциации K[Ag(CN)2] образуются ионы К+ и [Ag(CN)2]-, который ведет себя в обменных реакциях как неразрывное целое:
K[Ag(CN)2] + NH3 = K+ + [Ag(CN)2]- + NH3.
е) K[Ag(NO2)2] + NH3
При диссоциации K[Ag(NO2)2] образуются ионы K+ и [Ag(NO2)2]-, который обладает большой устойчивостью:
K[Ag(NO2)2] = K+ и [Ag(NO2)2]-. Реакция не протекает, так как ион [Ag(NH3)2]+ не образуется, потому что Kн([Ag(NO2)2]-) < ([Ag(NH3)2]+.
ж) [Ag(NH3)2]Cl + NiCl2
Как электролиты обе соли диссоциируют:
[Ag(NH3)2]Cl = [Ag(NH3)2]+ + Сl-;
NiCl2 = N12+ + 2Cl-.
Ионы Ag+ и Cl- соединяясь друг с другом образуют нерастворимое соединение AgCl, а ион Ni2+ с NH3 образует комплекс [Ni(NH3)6]2+, так как Kн (Ni(NH3)6]2+) < Kн([Ag(NH3)2]+), получим:
3[Ag(NH3)2]Cl + NiCl2 =
= [Ni(NH3)6]Сl2 + 3AgCl↓ (молекулярная форма);
3[Ag(NH3)2]+ + Cl- + Ni2+ + 2Cl- =
= [Ni(NH3)6]2+ + 2Сl- + 3AgCl↓ (полная ионная форма);
3[Ag(NH3)2]+ + Ni2+ + 3Cl- =
= [Ni(NH3)6]2+ + 3AgCl↓ (сокращенная ионная форма).
з) K3[Cu(CN)4] + Hg(NO3)2
Реакция протекает так как Kн[Cu(CN)4]3-) > Kн([Hg(CN)4]2-, получим:
K3[Cu(CN)4] + Hg(NO3)2 =
= K2[Hg(CN)4] + KNO3 + CuNO3 (молекулярная форма);
3K+ + [Cu(CN)4]3- + Hg2+ + 2NO3- =
= 3K+ + [Hg(CN)4]2- + 2NO3- + Cu+ (полная ионная форма);
[Cu(CN)4]3- + Hg2+ =
= [Hg(CN)4]2- + Cu+ (сокращенная ионная форма).
Задача 730.
Вычислить концентрацию ионов Ag+ в 0,1 М растворе [Ag(NH3)2]NO3, содержащем в избытке 1 моль/л NH3.
Решение:
Константа нестойкости иона [Ag(NH3)2]+ равна 9,3 . 10-8. Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(NH3)2]+ = Ag+ + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда [NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2]+ может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
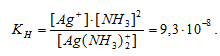
Отсюда выражаем концентрацию ионов Ag+:
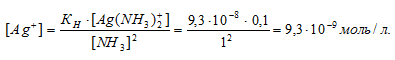
Ответ: 9,3 . 10-8 моль/л.
Задача 731.
Вычислить концентрацию ионов кадмия в 0,1 М растворе K2[Cd(CN)4], содержащем, кроме того, 6,5 г/л КCN.
Решение:
M(KCN) = 65г/моль. Рассчитаем концентрацию цианида калия:
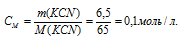
Константа нестойкости иона [Cd(CN)4]2+ равна 7,8 . 10-18. Вторичная диссоциация комплексного иона протекает по схеме:
[Cd(CN)4]2- = Cd2+ + 4CN-
В присутствии избытка ионов CN-, создаваемого в результате диссоциации КCN (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов CN-, образующихся при вторичной диссоциации, можно пренебречь. Тогда [Сd2+] = С(соли) = 0,01 моль/л. По той же причине равновесная концентрация ионов [Cd(CN)4]2- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
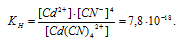
Отсюда выражаем концентрацию ионов Сd2+:
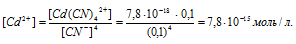
Ответ: 7,8 . 10-15 моль/л.
Задача 732.
Найти массу серебра, находящегося в виде ионов в 0,5 л 0,1 М раствора дитиосульфатоаргентата натрия Na3[Ag(S2O3)2], содержащем, кроме того, 0,1 моль/л тиосульфата натрия.
Решение:
М(Ag) = 107,868 г/моль. Константа нестойкости иона [Ag(S2O3)2]3- равна 1,1 . 10-13. Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(S2O3)2]3- = Ag+ + 2S2O32-
В присутствии избытка ионов S2O32-, создаваемого в результате диссоциации К2S2O3 (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов S2O32-, образующихся при вторичной диссоциации, можно пренебречь. Тогда [Ag+] = С(К2S2O3) = 0,1 моль/л. По той же причине равновесная концентрация ионов [Ag(S2O3)2]3- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).По условию задачи:
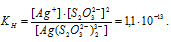
Отсюда выражаем концентрацию ионов Ag+:
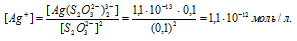
Теперь рассчитаем массу серебра, находящуюся в виде ионов в количестве 1,1 . 10-12 моль/л в растворе комплексной соли:
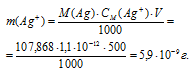
Ответ: 5,9 . 10-9 г.
Задача 733.
Выпадет ли осадок галогенида серебра при прибавлении к 1 л 0,1 м раствора [Ag(NH3)2]NO3, содержащему 1 моль/л аммиака: а) 1 . 10-5 моль КВг; б) 1 . 10-5 моль КI? ПР(AgBr) = 6 . 10-13; ПР(AgI) = 1,1 . 10-16.
Решение:
Константа нестойкости иона [Ag(NH3)2]+ равна 9,3 . 10-9. Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(NH3)2]+ = Ag+ + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда {NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2]+ может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
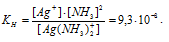
Отсюда выражаем концентрацию ионов Ag+:
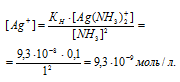
а) Уравнение реакции имеет вид:
[Ag(NH3)2]NO3 + KBr = AgBr + KNO3 + 2NH3↑
Из уравнения реакции следует, что из 1 моль КBr и 1 моль [Ag(NH3)2]NO3 образуется 1 моль AgBr. Так как [Ag+] = 9,3 . 10-9 моль/л; [Br-] =1 . 10-5 моль/л, то произведение концентраций ионов Ag+ и Br- будет равна: (9,3 . 10-9) .(1 . 10-5) = 9,3 . 10-14. Так как 9,3 . 10-14 > 1,1 . 10-16, то осадок бромида серебра не образуется.

