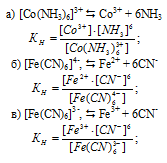Выражения для констант нестойкости комплексных ионов
Решение задач по химии на константу нестойкости комплексных соединений
Задание 312.
Напишите выражения для констант нестойкости комплексных ионов [Аg(NH3)2]+, [Fe(CN)6]4-, [РtCl6]2-. Чему равны степень окисления и координационное число комплексообразователей в этих ионах?
Решение:
Комплексная соль в водном растворе диссоциирует по типу сильного электролита, т. е. практически полностью до комплексного иона (внутренняя сфера) и иона внешней сферы. Обратимый распад внутренней сферы комплексного соединения называют вторичной диссоциацией. В результате вторичной диссоциация и устанавливается равновесие между комплексной частицей (комплексным ионом), центральным ионом и лигандами. Константа равновесия диссоциации комплексного иона называется . Чем меньше численное значение константы нестойкости (КН), тем более прочен данный комплексный ион.
Выражения для :
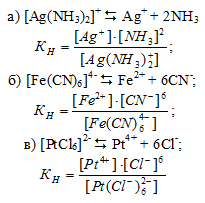
2. Степень окисления комплексообразователя определяется так же как и степень окисления элемента в любом химическом соединении исходя из того, что сумма степеней окисления всех атомов элементов в молекуле вещества равна нулю. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него.
Отсюда
Степень окисл. Координ. Число
а) [Аg(NH3)2]+ +1 2
б) [Fe(CN)6]4– +2 6
в) [РtCl6]2– +4 6
Задание 314
Напишите выражения для констант нестойкости следующих комплексных ионов: [Аg(CN)2]-, [Аg(NH3)2]+, [Аg(SCN)2]-. Зная, что они соответственно равны 1,0 . 10-21; 6,8 . 10-8; 2,0 . 10-11, укажите, в каком растворе, содержащем эти ноны, при равной молярной концентрации ионов Аg+ больше.
Решение:
Известно, что чем устойчивее комплексный ион, тем меньшее численное значение имеет константа нестойкости данного комплексного иона и наоборот – чем большее численное значение имеет константа нестойкости комплексного иона, тем мене он устойчив. Так как константа нестойкости комплексного иона [Аg(NH3)2]+ (6,8 . 10-8) имеет наибольшее значение, чем ионов [Аg(CN)2]– (1,0 . 10-21) и [Аg(SCN)2]– (2,0 . 10-11), то при равной молярной концентрации ионов Ag+ больше в растворе [Аg(NH3)2]+.
Обратимый распад внутренней сферы комплексного соединения называют вторичной диссоциацией. В результате вторичной диссоциация и устанавливается равновесие между комплексной частицей (комплексным ионом), центральным ионом и лигандами. Константа равновесия диссоциации комплексного иона называется константой нестойкости комплексного иона. Чем меньше численное значение константы нестойкости (КН), тем более прочен данный комплексный ион.
Выражения для констант нестойкости комплексных ионов:
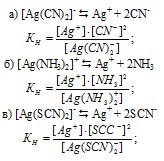
Задание 320.
Константы нестойкости комплексных ионов [Со(NH3)6]3+, [Fe(CN)6]4–, [Fe(CN)6]3– соответственно равны 6,2 . 10-36; 1,0 . 10-37; 1,0 . 10-44. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ноны.
Решение:
Известно, что чем устойчивее комплексный ион, тем меньшее численное значение имеет константа нестойкости данного комплексного иона и наоборот – чем большее численное значение имеет константа нестойкости комплексного иона, тем мене он устойчив. Так как константа нестойкости комплексного иона [Fe(CN)6]3- (1,0 . 10-44) имеет наименьшее значение, чем ионов [Со(NH3)6]3+ (6,2.10-36) и [Fe(CN)6]4- (1,0 . 10-37), то более прочным ионом будет [Fe(CN)6]3-.
Обратимый распад внутренней сферы комплексного соединения называют вторичной диссоциацией. В результате вторичной диссоциации и устанавливается равновесие между комплексной частицей (комплексным ионом), центральным ионом и лигандами. Константа равновесия диссоциации комплексного иона называется константой нестойкости комплексного иона. Чем меньше численное значение константы нестойкости (КН), тем более прочен данный комплексный ион.
Выражения для констант нестойкости комплексных ионов: