Уравнения реакций образования комплексных ионов ртути и серебра
Задание 395.
При постепенном прибавлении раствора КI к раствору Нg(NO3)2 образующийся вначале осадок растворяется. Какое комплексное соединение при этом получается? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
Решение:
При постепенном прибавлении раствора KI к раствору Нg(NO3)2 образуется осадок йодида ртути:
2KI + Hg(NO3)2 = HgI2↓ + 2KNO3 (молекулярная форма);
2I- + Hg2+ = HgI2↓ (ионно-молекулярная форма)
Образовавшийся осадок HgI2 растворяется в избытке КI, потому что образуется комплексный ион [HgI4]2-:
HgI2 + 2KI = K2[HgI4] (молекулярная форма);
HgI2 +2I- = [HgI4]2- (ионно-молекулярная форма)
Задание 397.
При сливании растворов нитрата серебра и цианида калия выпадает осадок, который легко растворяется в избытке КС1. Какое комплексное соединение при этом получается. Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
Решение:
Осадок малорастворимого AgCN образуется при введении цианида калия в раствор AgNO3:
KCN + AgNO3 = AgCN↓ + KNO3 (молекулярная форма);
CN- + Ag+ = AgCN↓ (ионно-молекулярная форма).
При действии избытка цианида калия на цианид серебра осадок растворяется, потому что образуется растворимое комплексное соединение K[Ag(CN)2]:
AgCN + KCN = K[Ag(CN)2] (молекулярная форма);
AgCN + CN- = [Ag(CN)2]- (ионно-молекулярная форма).
Задание 730 (г).
Вычислить концентрацию ионов [Ag+] в 0,1 М растворе [Ag(NH3)2]NO3, содержащем в избытке 1 моль/л NH3.
Решение:
Константа нестойкости иона [Ag(NH3)2]+ равна 9,3 . 10-8. Вторичная диссоциация комплексный ион протекает по схеме:
[Ag(NH3)2]+ ⇔Ag+ + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда [NH3] = С . (NH3) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2]+ может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
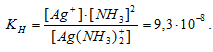
Отсюда выражаем концентрацию ионов Ag+:
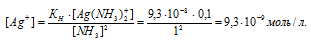
Ответ: 9,3 . 10-9.

