Химические свойства марганца
Задание 417.
Марганец окисляется азотной кислотой до низшей степени окисления, а рений приобретает высшую степень окисления. Какие соединения при этом получаются? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Марганец взаимодействует с азотной кислотой с образованием нитрата марганца (II) оксида азота (II)
Уравнения электронного баланса:
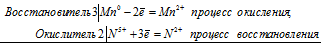
3Mn0 + 2N5+ = 3Mn2+ + 2N2+
Молекулярное уравнение реакции:
3Mn + 8HNO3 =
= 3Mn(NO3)2 + 2NO + 4H2O;
б) Рений окисляется азотной кислотой до высшей степени окисления. При этом образуются рениевая кислота HReO4 и оксид азота (II) NO:
Уравнения электронного баланса:
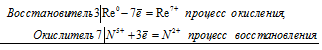
3Re0 + 7N5+ = 3Re2+ + 7N2+
Молекулярное уравнение реакции:
3Re + 7HNO3 = 3HReO4 + 7NO + 2H2O
Задание 418.
Хлор окисляет манганат калия К2MnO4. Какое соединение при этом получается? Как меняется окраска раствора в результате этой реакции? Составьте электронные и молекулярное уравнения реакции.
Решение:
При окислении хлором манганата калия образуются перманганат калия и хлорид калия:
Уравнения электронного баланса:
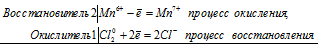
2Mn6+ + Сl20 = 2Mn7+ + 2Cl-
Молекулярное уравнение реакции:
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl.
Манганат-ионы MnO42- окрашивают раствор в ярко-зелёный цвет, перманганат-ионы MnO4- в красно-фиолетовый. Поэтому при окислении манганата калия хлором раствор изменяет окраску с ярко-зелёного на красно-фиолетовый цвет.
Задание 419.
Как меняется степень окисления марганца при восстановлении КМпО4 в кислой, нейтральной и щелочной средах? Составьте электронные и молекулярное уравнения реакций между КМпО4 и KNO2 в нейтральной среде.
Решение:
Степень окисления марганца при восстановлении КМпО4 в кислой, нейтральной и щелочной средах меняется следующим образом: в кислой среде марганец уменьшает свою степень окисления от +7 до +2 (перманганат-ион MnO4- превращается в ион Mn2+); в нейтральной среде марганец уменьшает свою степень окисления от +7 до +4 (ион MnO4- восстанавливается до MnO2); в щелочной среде марганец уменьшает свою степень окисления от +7 до +6 (ион MnO4- превращается в ион MnO42-).
Электронные и молекулярное уравнения реакций между КМпО4 и KNO2 в нейтральной среде:
Уравнения электронного баланса:
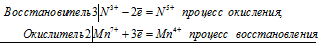
2Mn7+ + 3N3+ = 2Mn4+ + 3N5+
Молекулярное уравнение реакции:
2KMnO4 + 3KNO2 + H2O =
= 2MnO2↓ + 3KNO3 + 2KOH.
Задание 420.
На основании электронных уравнений составьте уравнение реакции получения манганата калия K2MnO4 сплавлением оксида марганца (IV) с хлоратом калия КСlО3 в присутствии гидроксида калия. Окислитель восстанавливается максимально, приобретая низшую степень окисления.
Решение:
При сплавлении MnO2 со щёлочью ) с хлоратом калия КСlО3 в присутствии гидроксида калия образуются манганат калия, хлорид калия и вода:
Уравнения электронного баланса:

3Mn4+ + Сl5+ = 3Mn6+ + Cl-
Молекулярное уравнение реакции:
3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O
Задание 421.
Почему оксид марганца (IV) может проявлять и окислительные, и восстанвительные свойства? Исходя из электронных уравнений, составьте уравнения реакций:
а)МnО2 + КI + Н2SO4 = ; б)МnO2 + КNO3 + КОН = .
Решение:
Марганец в MnO2 находится в своей промежуточной степени окисления +4, поэтому в окислительно-восстановительных реакциях атом марганца в оксиде марганца (IV) может как увеличивать свою степень окисления, т.е. проявлять свойства восстановителя, так и уменьшать свою степень окисления – проявлять свойства окислителя.
Уравнения реакций:
а)МnО2 + КI + Н2SO4 =
Уравнения электронного баланса:
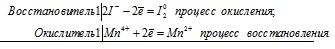
Mn4+ + 2I- = Mn2+ + I20
Молекулярное уравнение реакции:
MnO2 + 2KI + 2H2SO4 = MnSO4 + K2SO4 + I2 + 2H2O
б)МnO2 + КNO3 + КОН = .
Уравнения электронного баланса:
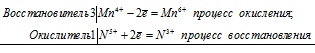
Mn4+ + N5+ = Mn6+ + N3+
Молекулярное уравнение реакции:
3MnO2 + KNO3 + 2KOH = K2MnO4 + KNO2 + H2O
Задание 422.
Для получения хлора в лаборатории смешивают оксид марганца (IV) с хлоридом натрия в присутствии концентрированной серной кислоты. Составьте электронные и молекулярное уравнения этой реакции.
Решение:
Уравнение реакции получения хлора в лаборатории
Уравнения электронного баланса:
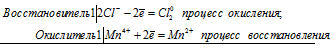
Mn4+ + 2Cl- = Mn2+ + Cl20
Молекулярное уравнение реакции:
MnO2 + 2KCl + 2H2SO4 = MnSO4 + K2SO4 + Cl2 + 2H2O

