Составление молекулярных и ионно-молекулярных уравнений реакций
Решение задач на составление уравнений окислительно-восстановительных реакций
Задание 181.
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) NaHCO3 и NaОН; б) К2SiO3 и НСI; в) ВаСI2 и Na2SO4.
Решение:
Молекулярная форма уравнений:
а) NaHCO3 + NaОН 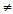 ;
;
Отметим, что взаимодействие NaHCO3 и NaОН невозможно, так как нахождение в растворе после смешения веществ ионов Na+, НСО3- и ОН- не приводит к взаимодействию их друг с другом с образованием осадка, газа или слабого электролита.
б) К2SiO3 + 2НСI = 2KCl + H2SiO3↓;
в) ВаСI2 + Na2SO4 = BaSO4↓ + 2NaCl.
Реакции (б) и (в) протекают, так как образуются малорастворимые соединения (H2SiO3 и BaSO4).
Ионно-молекулярные уравнения реакций будут иметь вид:
a) 2Н+ + SiO32- = H2SiO3↓;
в) Ba2+ + SO42- = BaSO4↓.
Задание 182.
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) К2S и НС1; б) ЕеSO4 и (NH4)2S; в) Сг(ОН)3 и КОН.
Решение:
Запишем взаимодействие указанных веществ в молекулярном виде:
а) К2S + НСl = 2KCl + H2S↑;
б) ЕеSO4 + (NH4)2S = FeS↓ + (NH4)2SO4;
в) Сг(ОН)3 + 3КОН = K3[Cr(OH)6].
Отметим, что взаимодействие этих веществ возможно, ибо в результате реакции (а) образуется слабый электролит H2S (происходит связывание ионов Н+ и S2-), в результате реакции (б) образуется осадок FeS, а при протекании реакции (в) происходит растворение Сг(ОН)3 с образованием комплексного иона [Cr(OH)6]3-. Исключив одинаковые ионы из обеих частей равенств [а) К+ и Cl-; б) NH4+ и SO42-; в) К+], получим ионно-молекулярные уравнения этих реакций:
а) 2Н+ + S2- = H2S↑;
б) Fe2+ + S2- = FeS↓;
в) Cr(OH)3 + 3OH- + [Cr(OH)6]3-

