Расчет молярных веществ, температуры кристаллизации и кипения растворов неэлектролитов
Молярная масса растворенного вещества
Расчеты температуры кристаллизации, молярной массы вещества
Криоскопическая константа
Задание 168.
Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при -0,465 °С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 342 г/молы.
Решение:
Температура кристаллизации чистой воды равна 0 oС, следовательно,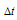 = 0 - (-0,465) = +0,4650. Масса неэлектролита (m1), приходящегося на 1000 г растворителя (воды) равна:
= 0 - (-0,465) = +0,4650. Масса неэлектролита (m1), приходящегося на 1000 г растворителя (воды) равна:
m1 = (25,65 . 1000)/300 = 85,5 г.
Тогда с расчётом того, что неэлектролит растворён в 1000 г воды, получим:
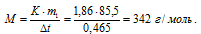
Ответ: 342 г/моль.
Задание 169.
Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718°С. Температура кристаллизации уксусной кислоты 16,65 °С. Ответ: 3,9°С.
Решение:
Понижение температуры кристаллизации равно: 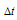 = 16,65 – 15,718 = 0,9320. М(С14Н10) = 178 г/моль. криоскопическую константу уксусной кислоты вычислим, используя уравнение Рауля:
= 16,65 – 15,718 = 0,9320. М(С14Н10) = 178 г/моль. криоскопическую константу уксусной кислоты вычислим, используя уравнение Рауля:
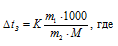
К – криоскопическая константа; m1 – масса растворённого вещества; m2 – масса растворителя; М – молярная масса растворённого вещества; 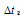 – понижение температуры замерзания раствора.
– понижение температуры замерзания раствора.
Отсюда
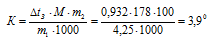
Ответ: 3,9 °С.
Расчет количества атомов серы
Задание 170.
При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81 °С. Сколько атомов содержит молекула серы в этом растворе. Эбулиоскопическая константа бензола 57°С. Ответ: 8.
Решение:
Для расчета используем уравнение:
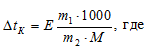
Е – эбулиоскопическая константа; m1 – масса растворённого вещества, 5 г; m2 – масса растворителя 95г;
М – молярная масса растворённого вещества; 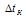 – повышение температуры кипения раствора.
– повышение температуры кипения раствора.
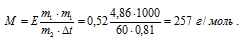
Для нахождения формулы серы нужно полученную молярную массу разделить на атомную массу серы (32,066 г/моль):
n = M/Ar(S) = 257/32,066 = 8 атомов
Формула вещества имеет вид - S8.
Ответ: 8 атомов серы.
Молярная масса растворенного вещества
Задание 171.
Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна -0,558 °С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86. Ответ: 442 г/моль.
Решение:
Температура кристаллизации чистой воды равна 0 оС, следовательно, 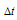 = 0 - (-0,558) = +0,5580. Для расчета используем уравнение:
= 0 - (-0,558) = +0,5580. Для расчета используем уравнение:
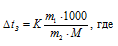
К – криоскопическая константа; m1 – масса растворённого вещества; m2 – масса растворителя; М – молярная масса растворённого вещества; 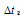 – понижение температуры замерзания раствора.
– понижение температуры замерзания раствора.
Тогда
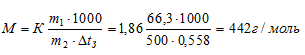
Ответ: 442 г/моль.
Расчет массы анилина в растворе
Задание 172.
Какую массу анилина C6H5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53°. Эбулиоскопическая константа этилового эфира 2,12о. Ответ: 1,16 г.
Решение:
Для расчета используем уравнение:
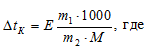
Е – эбулиоскопическая константа; m1 – масса растворённого вещества, 5 г; m2 – масса растворителя 95г; М – молярная масса растворённого вещества [М(C6H5NH2) = 93 г/моль];  – понижение температуры замерзания раствора.
– понижение температуры замерзания раствора.
Отсюда

Ответ: 1,16 г.
Температура кристаллизации раствора
Задание 173.
Вычислите температуру кристаллизации 2%ного раствора этилового спирта С2Н5ОН. Криоскопическая константа воды 1,860. Ответ: -0,825 oС.
Решение:
Для расчета понижения температуры кристаллизации этилового спирта используем уравнение:
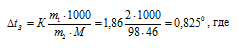
К – криоскопическая константа; m1 – масса растворённого вещества, 5 г; m2 – масса растворителя 95г; М – молярная масса растворённого вещества [М(С2Н5ОН) = 46 г/моль]; 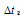 – понижение температуры замерзания раствора.
– понижение температуры замерзания раствора.
Вода кристаллизуется при 0 оС, следовательно, температура кристаллизации раствора равна:
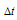 = 0 - 0,825 = -0,825оС.
= 0 - 0,825 = -0,825оС.
Ответ: -0,825 оС.
Рассчет массы мочевины в растворе
Задание 174.
Сколько граммов мочевины (NH2)2CO следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465°? Криоскопическая константа воды 1,86°. Ответ: 1,12 г.
Решение:
М((NH2)2CO) = 60 г/моль. Для нахождения массы мочевины используем уравнение:
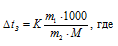
К – криоскопическая константа; m1 – масса растворённого вещества, 5 г; m2 – масса растворителя 95г; М – молярная масса растворённого вещества [М(С2Н5ОН) = 46 г/моль]; 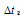 – понижение температуры замерзания раствора.
– понижение температуры замерзания раствора.
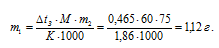
Ответ: 1,12 г.

