Выполнение проверочного задания по общей и неорганической химии
Задание 2
1) Вычислите: а) молярную; б) нормальную; в) моляльную концентрации и титр 40%-ного раствора HNO3, плотность раствора 1,251 г/см3.
2) При какой температуре будет кипеть и замерзать 40%-ный водный раствор глицерина СЗН8OЗ? К = 1‚86; Е = 0‚52.
3) Концентрация ионов водорода в растворах: [H+] = 10-3; 10-6; 10-12 молъ/л. Определите pH и концентрацию гидроксид-ионов в этих растворах. Укажите характер среды.
4) Напишите ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) CaSO4 и Na3PO4; б)Na2S и Pb(NO3)2; в) Na2CO3 и Ca(HCO3)2.
5) Вода, содержащая только гидрокарбонат магния, имеет жесткость 6.0 мэкв/л. Какая масса гидрокарбоната магния содержится в 5 м3 воды? Напишите уравнения реакции для устранения жесткости этой воды.
Решение:
1. Вычисление концентраций и титра раствора HNO3
w% = 40%;
M(HNO3) = 63 г/моль;
p(p-pa) = 1,251 г/см3.
Рассчитаем массу 40%-ного раствора HNO3 плотностью раствора 1,251 г/см3, получим:
m(p-pa) = V9p-pa) . p(p-pa) =
= 1000 . 1,251 = 1251 г = 1,251 кг.
Определим массу HNO3 в растворе, получим:
m(HNO3) = [m(p-pa) . w%]/100% =
= 1251 . 40/100% = 500,4 г = 0,5004 кг.
а) Расчет молярной концентрации 40%-ного раствора HNO3
Молярная концентрация показывает количество моль вещества в 1 л его раствора, получим:
СМ = n(HNO3) = m(HNO3)/M(HNO3) =
= 500,4/63 = 7,94 моль/л или 7,94М.
б) Расчет нормальности 40%-ного раствора HNO3
Нормальность раствора показывает количество эквивалентов вещества в 1 л его раствора, получим:
Учитывая, что азотная кислота одноосновная, то СМ = СН
CH = СМ = m(HNO3) г/M(HNO3) г/моль . 1 л =
= 7,94 моль/л или 7,94Н.
в) Расчет моляльной концентрации 40%-ного раствора HNO3
Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя.
Моляльность m = (7,94 моль)/(1,251 кг –0,5004 кг) =
= (7,94 моль)/0.7506 кг = 10,58 моль/кг воды.
в) Расчет титра раствора HNO3, получим:
Титр раствора — число граммов растворённого вещества на 1 см3 раствора.
Тогда
Т(HNO3) = m(HNO3)/1000 = 500,4/1000 = 0,5004 г/см3.
2. Определение температуры кипения и замерзания 40%-ного водного раствор глицерина
М(СЗН8OЗ) = 92 г/моль.
а) Расчет температуры кипения глицерина
По закону Рауля раствор закипает при более высокой температуре, так как концентрация молекул растворителя в нём всегда ниже, чем в чистом растворителе, и давление насыщенного пара раствора достигает атмосферного при более высокой температуре. Выражается это уравнением:
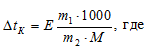
Е – эбулиоскопическая константа; m1 – масса растворённого вещества, 40 г; m2 – масса растворителя, 60 г; М – молярная масса растворённого вещества, 92 г/моль; ∆tк – понижение температуры кипения раствора.
Повышение температуры кипения раствора глицерина:
∆tк = (0,52 . 40 . 1000)/(92 . 60) = 20800/5520 = 3,77.
Следовательно, температура кипения раствора:
t(ра-ра) = t(ра-ля) +∆tк = 3,77 + 100 = 103,77 oС.
Ответ: 103,77 oС.
б) Расчет температуры замерзания глицерина
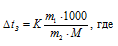
К – криоскопическая константа; m1 – масса растворённого вещества, 40 г; m2 – масса растворителя, 60 г; М – молярная масса растворённого вещества, 92 г/моль; ∆tз – понижение температуры замерзания раствора.
Понижение температуры замерзания раствора глицерина:
∆tз = (1,86 . 40 . 1000)/(92 . 60) = 74400/5520 = 13,48.
Следовательно, температура замерзания раствора:
t(ра-ра) = t(ра-ля) + ∆tз = 0 + 13,48 = -13,48 oС.
Ответ: -13,48 oС.
3. Определениее pH и концентрации гидроксид-ионов в растворах
а) Определите pH и концентрацию гидроксид-ионов, если концентрация ионов водорода в растворах составляет 1 . 10-3 молъ/л, получим:
pH = -lg[H+] = -lg1 . 10-3 = 3 - lg1 = 3 - 0 = 3.
Из соотношения: pH + pOH = 14
Находим:
pOH = 14 - рН = 14 - 3 = 11
Концентрация гидроксид-ионов:
рОН = -lg[OH–]; [OH–] =
= -lgрОН = -lg11 = 1 . 10-11 молъ/л.
Ответ: рН = 3; [OH–] = 1 . 10-11 молъ/л.
б) Определите pH и концентрацию гидроксид-ионов, если концентрация ионов водорода в растворах составляет 1 . 10-6 молъ/л, получим:
pH = -lg[H+] = -lg1 . 10-6 = 6 - lg1 = 6 - 0 = 6.
Из соотношения: pH + pOH = 14
Находим:
pOH = 14 - рН = 14 - 6 = 8
Концентрация гидроксид-ионов:
рОН = -lg[OH–]; [OH–] = -lgрОН = -lg8 = 1 . 10-8 молъ/л.
Ответ: рН = 6; [OH–] = 1 . 10-8 молъ/л.
в) Определите pH и концентрацию гидроксид-ионов, если концентрация ионов водорода в растворах составляет 1 . 10-12 молъ/л, получим:
pH = -lg[H+] = -lg1 . 10-12 = 12 - lg1 = 12 - 0 = 12.
Из соотношения: pH + pOH = 14
Находим:
pOH = 14 - рН = 14 - 12 = 2
Концентрация гидроксид-ионов:
рОН = -lg[OH–]; [OH–] = -lgрОН = -lg2 = 1 . 10-2 молъ/л.
Ответ: рН = 12; [OH–] = 1 . 10-2 молъ/л.
4. Ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) CaSO4 и Na3PO4; б)Na2S и Pb(NO3)2; в) Na2CO3 и Ca(HCO3)2.
а) CaSO4 и Na3PO4
3CaSO4 + 2Na3PO4 = Са3(РО4)2↓ + 3Na2SO4 - (молекулярная форма);
3Ca2+ + 3SO42- + 6Na+ + 2PO43- =
= Са3(РО4)2↓ + 6Na+ + 3SO42- - (ионно-молекулярная форма);
3Ca2+ + 2PO43- = Са3(РО4)2↓ - (сокращенная ионно-молекулярная форма).
б) Na2S и Pb(NO3)2
Na2S + Pb(NO3)2 = PbS↓ + 2NaNO3 - (молекулярная форма);
2Na+ + S2- + Pb2+ + 2NO3- =
= PbS↓ + 2Na+ + 2NO3- - (ионно-молекулярная форма);
Pb2+ + S2- = PbS↓ - (сокращенная ионно-молекулярная форма).
в) Na2CO3 и Ca(HCO3)2
Na2CO3 + Ca(HCO3)2 = CaCO3↓ + 2NaHCO3 - (молекулярная форма);
2Na+ + CO32- + Ca2+ + 2HCO3- = CaCO3↓ + 2Na+ + 2HCO3- - (ионно-молекулярная форма);
Ca2+ + CO32- = CaCO3↓ - (сокращенная ионно-молекулярная форма).
5. Расчет гидрокарбоната магния в воде. Устранение жесткости воды
а) Расчет массы гидрокарбоната магния в 5 м3 воды
Молярная масса эквивалента Mg(HCO3)2 = M/2 = 146,34 г/моль/2 = 73,17 г/моль. Массу гидрокарбоната магния, содержащуюся в воде находим из формулы:
Ж = m(В)/[MЭ(В).V], где
m – масса вещества В, обуславливающая жёсткость воды, мг; MЭ(В) – молярная масса эквивалента вещества В, мг/моль; V – объём воды, л.
Отсюда
m(В) = Ж . MЭ(В) . V; m[Mg(HCO3)2] =
= 6 . 73,17 . 5000 = 2195100 мг или 2195,1 г.
Ответ: m[Mg(HCO3)2] = 2195,1 г.
б) Уравнения реакции для устранения жесткости воды
Карбонатную («временную») жёсткость можно устранить введением ионов ОН–. Обычно используют Са(ОН)2 или Na2CO3:
Mg(НСО3)2 + Na2CO3 = MgCO3↓ + 2NaHCO3;
Mg(НСО3)2 + Са(ОН)2 = MgCO3↓ + СаСО3↓ + 2Н2О

