Решение задач по химии на вычисление кажущейся степени диссоциации кислоты и соли
Задача 518.
Раствор, содержащий 0,53 г карбоната натрия в 200 г воды, кристаллизуется при -0,13 °С. Вычислить кажущуюся степень диссоциации соли.
Решение:
M(Na2CO3) = 106 г/моль.
Теперь определим понижение температуры кристаллизации  t(крист) раствора без учёта диссоциации щёлочи (криоскопическая константа для воды равна 1,86) по формуле:
t(крист) раствора без учёта диссоциации щёлочи (криоскопическая константа для воды равна 1,86) по формуле:
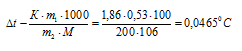
Здесь m1 - масса растворённого вещества, m2 - масса раствора, М – молярная масса растворённого вещества, К – криоскопическая константа.
Сравнивая найденное значение  t(теорет) с экспериментально полученным значением
t(теорет) с экспериментально полученным значением  t(экспер), рассчитаем изотонический коэффициент по формуле:
t(экспер), рассчитаем изотонический коэффициент по формуле:
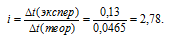
Рассчитаем кажущуюся степень диссоциации ( ) соли из соотношения:
) соли из соотношения:
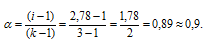
Здесь K - общее число ионов, образующихся при диссоциации электролита.
Ответ: 0,9.
Задача 519.
В равных количествах воды растворено в одном случае 0,5 моля сахара, а в другом - 0,2 моля СаСI2. Температуры кристаллизации обоих растворов одинаковы. Определить кажущуюся степень диссоциации СаСI2.
Решение:
Из уравнения  tз = KCM, где К – криоскопическая константа растворителя, которая для воды имеет значение 1,86; СМ – молярная концентрация раствора;
tз = KCM, где К – криоскопическая константа растворителя, которая для воды имеет значение 1,86; СМ – молярная концентрация раствора;  tз - понижение температуры замерзания раствора, получим:
tз - понижение температуры замерзания раствора, получим:
 tз(сахара) = 1,86 . 0,5 = 0,930 °С;
tз(сахара) = 1,86 . 0,5 = 0,930 °С;
 tз(СaCl2) = 1,86 . 0,2 = 0,372 °С
tз(СaCl2) = 1,86 . 0,2 = 0,372 °С
Теперь, учитывая, что температуры кристаллизации обоих растворов одинаковы и, сравнивая найденные значения  tз сахара и хлорида кальция найдём изотонический коэффициент (i), получим:
tз сахара и хлорида кальция найдём изотонический коэффициент (i), получим:
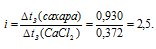
Рассчитаем кажущуюся степень диссоциации ( ) соли из соотношения:
) соли из соотношения:
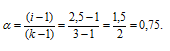
здесь K - общее число ионов, образующихся при диссоциации электролита.
Ответ: 0,9.
Задача 520.
При 100°С давление пара раствора, содержащего 0,05 моля сульфата натрия в 450 г воды, равно 100,8 кПа (756,2 мм рт. ст.). Определить кажущуюся степень диссоциации Na2SO4.
Решение:
Понижение давления пара над раствором вычисляем по уравнению:
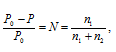
где Р0 – давление насыщенного пара над растворителем, 101,325 кПа; Р – давление насыщенного пара над раствором, 100,800 кПа; N – мольная доля растворённого вещества; n1, n2 – количества растворённого вещества и раствора. Находим количество воды в растворе:
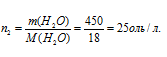
Тогда:
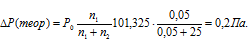
Находим экспериментальное значение:
 P(экспер) = P0 - P = 101,325 - 100,800 = 0,525 Па.
P(экспер) = P0 - P = 101,325 - 100,800 = 0,525 Па.
Рассчитаем изотонический коэффициент из соотношения:
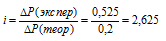
Рассчитаем кажущуюся степень диссоциации ( ) соли из соотношения:
) соли из соотношения:
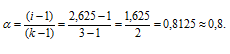
Здесь K - общее число ионов, образующихся при диссоциации электролита.
Ответ: 0,8.
Задача 521.
В 1 л 0,01М раствора уксусной кислоты содержится 6,26 . 10-21 ее молекул и ионов. Определить кажущуюся степень диссоциации уксусной кислоты.
Решение:
В 1 моль любого вещества содержится 6,02 . 10-23 молекул. Определим количество молекул, содержащееся в 0,01 моле уксусной кислоты из пропорции:
1 : 6,02 . 10-23 = 0,01 : x;
x = (0,01 . 6,02 . 10-23)/1 = 6,02 . 10-21
Изотонический коэффициент рассчитаем из сравнения теоретического и практического количеств молекул уксусной кислоты:
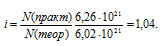
Рассчитаем кажущуюся степень диссоциации ( ) кислоты из соотношения:
) кислоты из соотношения:
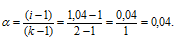
здесь K - общее число ионов, образующихся при диссоциации электролита.
Ответ: 0,04.

