Электролитическая диссоциация. Сильные и слабые электролиты. Степень диссоциации
Электролитическая диссоциация — это процесс распада вещества на ионы при его растворении или расплавлении.
Электролиты — вещества, распадающиеся на ионы в растворе или в расплаве. Положительные ионы называют катионами, отрицательные — анионами. При растворении веществ с ионной кристаллической решеткой в воде происходят разрыв ионных связей и гидратация образующихся ионов, например:
KCl → K+ + Cl–
В этом случае процесс диссоциации практически необратим. При растворении веществ с ковалентной полярной связью также могут происходить разрыв этой связи и гидратация образующихся ионов, например:
HCl ↔ H+ + Cl–
В этих случаях процесс диссоциации, как правило, обратим.
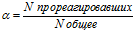
Количественной мерой электролитической диссоциации является степень диссоциации — отношение числа продиссоциировавших молекул к общему числу молекул вещества:
В зависимости от степени диссоциации электролиты делят на сильные и слабые.
К сильным электролитам относят те, для которых степень диссоциации в растворе с концентрацией 0.1 моль/л больше 0,3 (30%). Это практически все соли, сильные кислоты (НС1, Н2SО4, НNО3, НСlO4 и т.д.), гидроксиды щелочных и щелочно-земельных металлов.
К слабым электролитам относят те, для которых степень диссоциации в растворе с концентрацией 0.1 моль/л меньше 0,03 (3%). К ним относятся слабые кислоты (Н2СО3, Н2S, НNО2, НСlO, Н2SО3 и т. д., большинство органических кислот) и слабые основания (Аl(ОН)3, Zn(ОН)2 и т. д.). К слабым электролитам относится также вода.
Вещества, для которых степень диссоциации в растворе с концентрацией 0.1 моль/л составляет от 0.03 до 0,3 (3 - 30%), относят к электролитам средней силы. Например, Н3РО4, Н2SО3, НF, ССl3СООН и т.д.
Степень диссоциации зависит от концентрации вещества (она увеличивается при разбавлении раствора) и от температуры (при повышении температуры она также увеличивается).
Некоторые электролиты диссоциируют ступенчато (это многоосновные кислоты и многокислотные основания, а также кислые и основные соли), например:
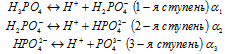
Степень диссоциации по каждой последующей ступени на несколько порядков меньше по сравнению с предыдущей:
а1 >> a2 >> A3
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор).

