Составление формул веществ хрома, селена, мышьяка, ванадия, серы, азота, углерода, сурьмы
Задание 47.
Какой из элементов четвертого периода - ванадий или мышьяк - обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов?
Решение:
+23V 1s22s22p63s23p63d34s2;
+33Аs 1s22s22p63s23p63d104s24p3.
Ванадий d-элемент VВ- группы, а мышьяк – р-элемент VА- группы. На внешнем энергетическом уровне у атома ванадия два электрона, а у атома мышьяка – пять. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять эти электроны. Эти атомы обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у ванадия сильнее выражены, чем у мышьяка.
Мышьяк с водородом образует газообразный гидрид AsH3 – арсин, где мышьяк проявляет отрицательную степень окисления -3, так как атом мышьяка способен присоединять три электрона до полного заполнения внешнего энергетического уровня:
Задание 48.
Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV).
Решение:
Марганец в своих соединениях проявляет степень окисления +2, +3, +4, +6, +7.
Формулы оксидов, отвечающих этим степеням окисления:
MnO – оксид марганца (II);
Mn2O3 - оксид марганца(III);
MnO2 - оксид марганца(IV);
MnO3 - ; оксид марганца(VI);
Mn2O7 - оксид марганца(VII).
Формулы гидроксидов марганца:
Mn(OH)2 – гидроксид марганца(II);
Mn(OH)3 – гидроксид марганца(III);
Mn(OH)4 – гидроксид марганца(IV);
H2MnO4 – марганцовистая кислота;
HMnO4 – марганцовая кислота.
Mn(OH)4 – гидроксид марганца(IV) – амфотерное основание, которое реагирует как с кислотами, так и со щелочами:
Mn(OH)4 + 4HCl = MnCl4 + 4H2O;
Mn(OH)4 + 4NaOH = Na4MnO4 + 4H2O
Задание 49.
У какого элемента четвертого периода - хрома или селена - сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена.
Решение:
Электронные формулы хрома и селена:
+24Cr 1s22s22p63s23p63d54s1;
+34Se 1s22s22p63s23p63d104s24p4.
Хром d-элемент VIВ- группы, а селен – р-элемент VIА – группы. На внешнем энергетическом уровне у атома хрома один электрон, а у атома селена – шесть. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять их. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, хром, как и все металлы, обладает только восстановительными свойствами, тогда как для селена, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у хрома сильнее выражены, чем у селена. К тому же селен, присоединив два электрона к наружному р-подуровню, проявляет отрицательную степень окисления и образует с водородом газообразное соединение H2Se, которое называют селеноводород.
Задание 50.
Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения?
Решение:
Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того числа электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2p6). Элементы хлор, сера, азот и углерод находятся соответственно в VIIА-, VIА-, VА-, IVА- группах и имеют структуру внешнего энергетического уровня s2p5, s2p4, s2p3, s2p2. Следовательно, низшая степень окисления хлора, серы, азота и углерода равны соответственно -1, -2, -3 и -4.
Формулы соединений алюминия с данными элементами в этой степени окисления:
AlCl3 – хлорид алюминия;
Al2S3 – сульфид алюминия;
AlN – нитрид алюминия;
Al4C3 – карбид алюминия.
Задание 51.
У какого из р-элементов пятой группы периодической системы - фосфора или сурьмы - сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атома этих элементов.
Решение:
Фосфор и сурьма находятся в VА- группе и имеют следующие электронные формулы:
+15Р 1s22s22p63s23p3;
+51Sb 1s22s22p63s23p63d104s24p64d105s25p3
На внешнем энергетическом уровне оба элемента содержат по пять валентных электронов, из которых два s-и три р-электрона.
Так как фосфор – элемент третьего периода, а сурьма – пятого, то из этого следует, что радиус атома фосфора значительно меньше, чем у атома сурьмы. В группах с увеличением порядкового номера элементов закономерно увеличиваются радиусы их атомов, что приводит к уменьшению связи внешних электронов; поэтому атом фосфора обладает определённым сродством к электрону, и, следовательно, приобретает отрицательную степень окисления и имеет больше шансов образовывать отрицательные ионы. Таким образом, фосфор, как все неметаллы, обладает только очень слабыми восстановительными свойствами и более сильными окислительными функциями. Сурьма, имея большие размеры атома, будет легче отдавать электроны внешнего энергетического уровня, чем принимать и поэтому будет проявлять восстановительные функции, т. е. обладать характерными металлическими свойствами.
Водородное соединение сурьмы (SbH3 - стибин) обладает более сильными восстанови-тельными свойствами, чем водородное соединение фосфора (РН3 - фосфин). Это объясняется тем, что в группах с ростом порядкового номера элемента закономерно возрастают радиусы атомов элементов и, соответственно ионные радиусы. Ион Sb3- имеет больший диаметр, чем ион Р3-, поэтому иону сурьмы значительно легче отдать электроны (из-за большего радиуса иона требуется меньше энергии на отрыв электрона).
Задание 52.
Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ва(ОН)2 или Мg(OH)2; Ca(OH)2 или Fе(ОН)2; Сd(ОН)2 или Sr(OH)2.
Решение:
Гидроксиды можно изобразить общей формулой ЭОН, где Э – металл. Гидроксиды могут диссоциировать по схеме:
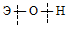
Диссоциация зависит от прочности и полярности связей Э — О и О — Н и может протекать по двум направлениям:
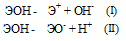
Прочность связей определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Если прочность связей Э — О и О — Н близки или равны , то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
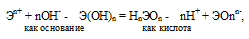
где
Э – элемент (металл или неметалл); n+ - положительная степень окисления элемента.
а) Ва(ОН)2 будет более сильным основанием, чем Mg(OH)2, так как эти элементы стоят во IIА- группе главной подгруппе, а в группе у элементов с увеличением порядкового номера увеличиваются размеры атомов (ионов), что уменьшает прочность связей Ва2+ с ОН-, чем у Mg2+ с ОН-.
б) Ca и Fe – элементы большого ряда четвёртого периода периодической системы химических элементов, поэтому с ростом порядкового номера элемента будет наблюдаться рост эффективного заряда, что приводит к уменьшению размеров атома (радиус атома железа будет намного меньше, чем радиус атома кальция). Из-за чего связь между Са2+ и ОН- будет значительно меньше, чем между Fe2+ с ОН-, значит, Са(ОН)2 будет проявлять сильнее основные свойства, чем Fe(ОН)2.
в) Стронций – типичный р-элемент IIА- группы, а кадмий – d-элемент IIВ- группы и у их атомов на внешнем энергетическом уровне содержатся по два электрона, поэтому они в своих соединения будут проявлять степень окисления +2. У кадмия порядковый номер (48) значительно больше, чем у стронция (38), поэтому радиус иона кадмия (Cd2+) имеет большее численное значение, чем у иона стронция (Sr2+), значит, связь между ионами Cd2+ и ОН- будет прочнее, чем связь между Sr2+ и ОН-, Sr(OH)2 будет проявлять меньше основных свойств чем Cd(ОН)2.
Задание 53.
Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: СuОН Или Сu(OH)2; Fе(ОН)2 или Fе(ОН)3; Sn(ОН)2 или Sn(ОН)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
Решение:
Если данный элемент проявляет переменную степень окисления (валентность) и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства послед-них меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э — О и О — Н может протекать по двум направлениям:
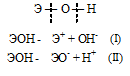
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Диссоциация по кислотному типу (II) протекает, если
ЕО—Н < < ЕЭ—О (высокая степень окисления), а по основному типу (I), если ЕО—Н >> ЕЭ—О (низкая степень окисления).
Если прочности связей Э — О и О — Н близки или равны, то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
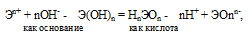
где
Э – элемент (металл или неметалл); n+ - положительная степень окисления элемента. Таким образом, исходя из степени окисления атомов соответствующих элементов, можно уверенно считать, что, если элемент образует два гидроксида, то более сильным основанием будет тот гидроксид, в котором степень окисления элемента имеет меньшее численное значение.
Отсюда вытекает, что гидроксид меди (I) CuOH более сильное основание, чем гидроксид меди (II) Cu(OH)2; а Fe(OH)2 более сильное основание, чем Fe(OH)3; Sn(OH)2 более сильное основание, чем Sn(OH)4.

