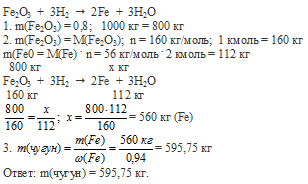"Химия. 11 класс". О.С. Габриелян (гдз)
Степень окисления. Электронное строение атомов
Вопрос 1.
Атомы металлов, располагающихся в главных подгруппах, имеют завершённый предыдущий d-подуровень (при его наличии), а атомы металлов, располагающихся в побочных подгруппах, имеют от 1 до 10 электронов на d-подуровне электронного слоя, равного номеру периода, в котором они располагаются.
Вопрос 2.
Валентная орбиталь щелочных металлов выглядит следующим образом ns1  , поэтому они могут проявлять единственную степень окисления +1, так как предыдущие подуровни полностью заполнены. Щелочно-земельные металлы имеют следующую валентную электронную оболочку:
, поэтому они могут проявлять единственную степень окисления +1, так как предыдущие подуровни полностью заполнены. Щелочно-земельные металлы имеют следующую валентную электронную оболочку:
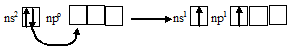
Поэтому могут проявлять единственную степень окисления +2.
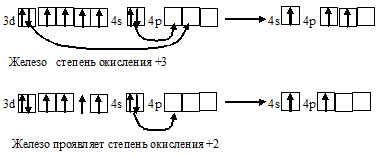
Металлы побочных подгрупп могут иметь различные степени окисления, так как содержат на d-подуровне некоторое количество электронных пар, которые можно распарить, так как исходное (основное) состояние менее устойчиво, чем при состоянии атома в возбуждённом состоянии.
Например:
Fe 1s22s22p63s23p63d64s2
Вопрос 3.
В своих соединениях марганец может проявлять степень окисления +2, +4, +6 и +7.
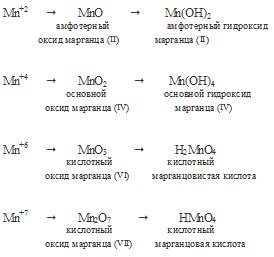
Вопрос 4.
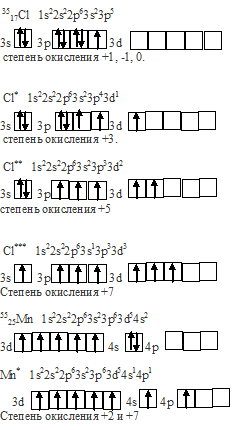
Вопрос 5.
Электрический ряд напряжений металлов составлен с учетом не только энергии отрыва электронов от отдельных атомов, но и энергии, затрачиваемой на разрушение кристаллической решетки, а также энергии, выделяющейся при гидратации ионов.
Положение металлов в Периодической системе определяется лишь энергией отрыва электронов от отдельных атомов.
Вопрос 6.
Наиболее активным является калий, так как он находится левее остальных металлов в электрохимическом ряду напряжений металлов.
Вопрос 7.
Наиболее выраженными окислительными свойствами обладают ноны Ag+ т.к. серебро находится правее остальных металлов в ряду напряжений.
Вопрос 8.
Полностью в разбавленной серной кислоте растворяется хромель (Ni, Cr, Co, Fe).
Вопрос 9.
2Na + 2CH3COOH → 2CH3COONa + H2↑
Mg + 2CH3COOH → (CH3COO)2Mg + H2↑
Скорость реакции натрия с уксусной кислотой больше, т.к. натрий более активный металл, чем магний.
Вопрос 10.
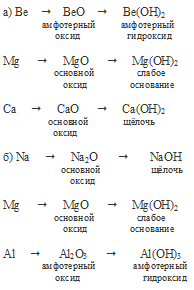
Наблюдается следующая закономерность:
Свойство оксидов и гидроксидов элементов в периоде слева направо, а в группах снизу вверх, сменяются от основных через амфотерные до кислотных.
Вопрос 11.
Способы получения металлов: 1. Пирометаллургия – восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов.
2. Гидрометаллургия – восстановление металлов из их солей в растворе.
3. Электрометаллургия – восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Вопрос 12.
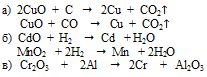
Вопрос 13.
В своих соединениях марганец может проявлять степень окисления +2, +4, +6 и +7.
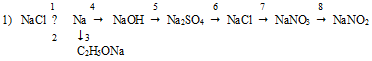
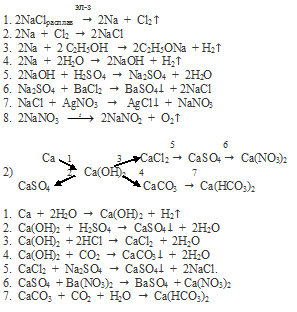
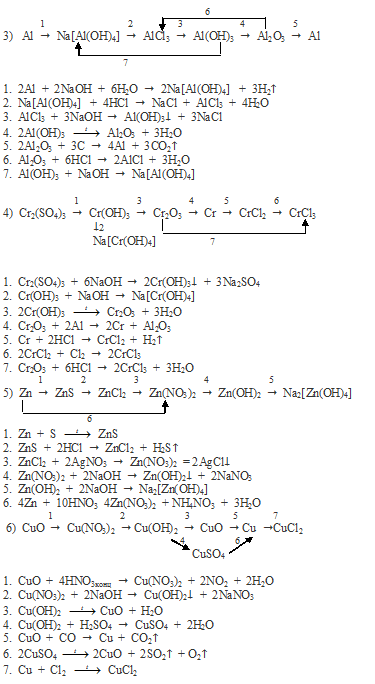
Вопрос 14.
Коррозия – процесс разрушения металла под действием окружающей среды. По механизму разрушения различают два типа коррозии.
1. Химическая - в основе лежит химическое взаимодействие.
2. Электрохимическая – наряду с химическими процессами наблюдаются и электрические. Является физико-химическим процессом.
Вопрос 15.
а) нельзя, так как коррозия – самопроизвольный процесс, а сварка – принудительный.
б) нельзя, так как получение «травлённой» кислоты процесс также принудительный, а коррозия – произвольный.
Вопрос 16.
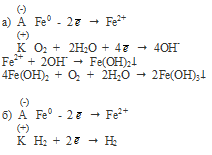
Вопрос 17.
Изделия из марганца и меди, соприкасающиеся и помещённые в воду, не будут сохраняться в неизменном виде – начнётся процесс коррозии.
Вопрос 18.
а) будет, так как магний находится в ряду напряжений левее железа;
б) не будет, так как свинец находится в ряду напряжений правее железа;
в) не будет, так как никель находитсяв ряду напряжений правее железа.
Вопрос 19.
Поверхности цистерн для хранения нефтепродуктов окрашивают серебритоном, так как растительное масло отталкивает воду, а алюминий образует прочную оксидную плёнку при окислении.
Вопрос 20.
Коррозии будет подвергаться труба, так как железо более активный металл, наиболее выражено разрушение в месте соединения крана и трубы, так как медь. Входящая в состав латуни, будет являться катодом в данном электрохимическом процессе.
Вопрос 21.
В процессе электролиза раствора на катоде может восстанавливаться либо металл, либо вода, а на аноде – либо анион, либо вода. В процессе электролиза расплава на катоде всегда восстанавливается металл, а на аноде анион.
Вопрос 22.
Электролизом расплавов но не растворов солей, можно получить металлы, стоящие в ряду напряжений металлов от лития до алюминия (включительно).
Вопрос 23.
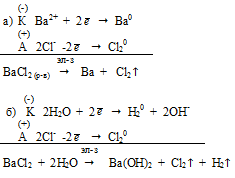
Вопрос 24.
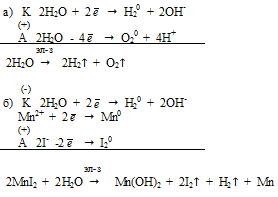
Вопрос 25.
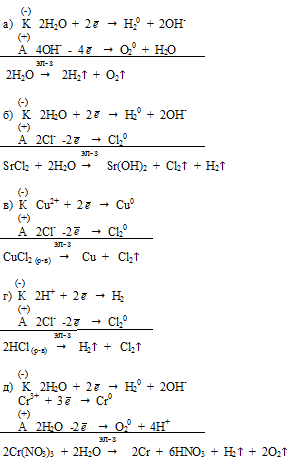
Вопрос 26.
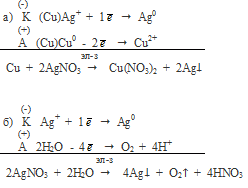
В случае растворимого анода окисляется металл анода, несмотря на природу металла.
Вопрос 27.
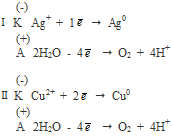
Сначала разрядятся катионы Ag+, затем Сu2+ (на катоде), в течение всего этого времени на аноде будет окисляться вода.
Вопрос 28.
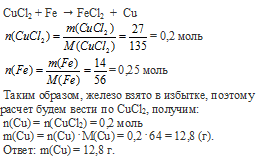
Вопрос 29.
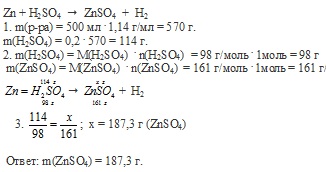
Вопрос 30.
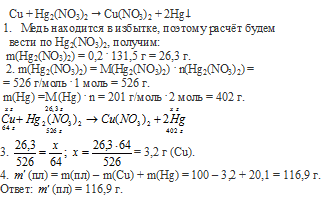
Вопрос 31.
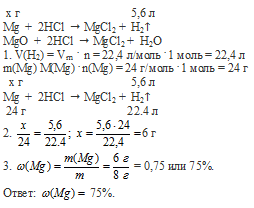
Вопрос 32.
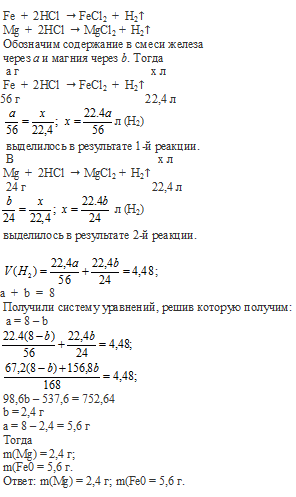
Вопрос 33.
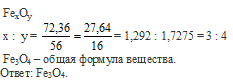
Вопрос 34.
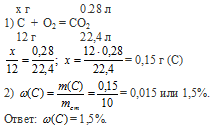
Вопрос 35.
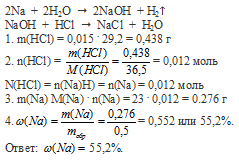
Вопрос 36.
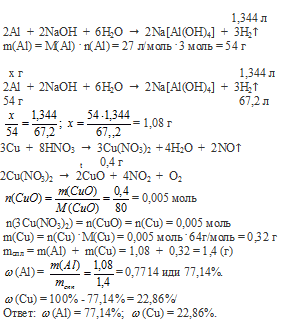
Вопрос 37.