Потенциалы ионизации (энергии ионизации) атомов элементов
Задача 195.
Для атома углерода значения последовательных потенциалов ионизации составляют (в В): I1 = 11,3, I2 = 24,4, I3 = 47,9, I4 = 64, I5 = 392. Объяснить: а) ход изменения потенциалов ионизации; б) чем вызван резкий скачок при переходе от I4 к I5.
Решение:
Энергией ионизации называют энергию, которую нужно затратить для отрыва электрона от атома с превращением его в положительно заряжённый ион. Энергию ионизации выражают в электрон-вольтах (эВ).
Энергию ионизацию можно определить, бомбардируя атомы электронами, ускоренными в электрическом поле. Наименьшую разность потенциалов, при которой скорость электронов становится достоянием для ионизации атомов, называют потенциалом ионизации атомов данного элемента. Потенциал ионизации (I), выраженный в вольтах (В), численно равен энергии ионизации (Е), выраженной в электрон-вольтах.
Первый потенциал ионизации соответствует энергии отрыва первого электрона, второй – энергии отрыва второго электрона и т.д. По мере отрыва электронов от атома положительный заряд образующегося иона возрастает, поэтому для отрыва каждого последующего электрона требуется большая затрата энергии, так что последовательные потенциалы ионизации атома углерода (I1, I2, I3, I4) возрастают. Особенно резко возрастает потенциал ионизации при отрыве электрона с главным квантовым числом меньшим, чем у предыдущего. Так в случае атома С (2s22p2) разность между I1 и I2 составляет I3,13 (24,4 – 11,3 = 13,В), что меньше, чем между I2 и I3 (23,5В) и между I3 и I4 (16,1В). Это связано с большей затратой энергии на удаление третьего электрона, находящегося, в отличие от двух предыдущих, на более близком от ядра расстоянии.
Резкий скачок потенциала ионизации при переходе от I4 к I5 можно объяснить тем, что после отрыва четырёх внешних электронов образуется система, состоящая из одного энергетического слоя (1s2), которая обладает высокой устойчивостью завершённого электронного слоя, а также меньшим значением n(n = 1).
Задача 196.
Энергии ионизации атомов благородных газов составляют (в эВ): Не 24,6; Ne 21,6; Аг — 15,8; Кг 14,0; Хе — 12,1; Ru — 10,8. Объяснить ход изменения энергии ионизации в этой подгруппе.
Решение:
Энергией ионизации называют энергию, которую нужно затратить для отрыва электрона от атома с превращением его в положительно заряжённый ион. Энергию ионизации выражают в электрон-вольтах (эВ). При достаточной энергии можно удалить из атома два, три и более электронов.
Электронная конфигурация валентных электронов благородных газов выражается общей формулой ns2np6. В пределах подгруппы радиусы ионов одинакового заряда возрастают с увеличением зарядов ядер, что объясняется увеличением числа электронных слоёв и растущим удалением внешних электронов от ядра. Всё это приводит к тому, что для отрыва электрона от атома неона будет затрачено больше энергии, чем от атома гелия. Поэтому наибольшей энергией ионизации будет обладать атом гелия, а наименьшей – атом радона.
Задача 197.
Значение первых потенциалов ионизации элементов I группы периодической системы элементов соответственно равны (в В): Li - 5,4; Сs - 3,9; Сu - 7,7; Аg - 9,2. Указать: а) у элементов какой подгруппы I группы металлические свойства выражены более резко; 6) чем объяснить различный ход изменения значений потенциалов ионизации в подгруппах.
Решение:
а) Элементы первой группы содержат на внешнем электронном слое по одному электрону. Атомы всех щелочных металлов имеют на внешнем энергетическом уровне единственный электрон. Общая конфигурация электронов их валентных подуровней. Валентный электрон эффективно экранирован от зарядов ядер электронами внутренних оболочек, которые имеют конфигурации оболочек благородных элементов. Поэтому первые энергии ионизации I1, у атомов щелочных металлов имеют небольшие значения. Другое следствие эффективного экранирования валентных электронов – большие атомные и, соответственно, ионные радиусы щелочных металлов.
Электронная конфигурация у элементов подгруппы меди имеют вид: (n - 1)d10ns1, т.е. на внешнем электронном слое находится по одному s-электрону, как и у элементов главной подгруппы. Однако, из-за того, что предпоследний слой у атомов меди и серебра, в отличие от атомов щелочных металлов, содержит восемнадцать электронов, что обуславливает большее электростатическое взаимодействие между положительно заряжённым ядром и электронами, приводящее к уменьшению атомного объёма. Поэтому медь и серебро – малоактивные металлы.
Потенциал ионизации (энергия ионизации) может служить мерой большей или меньшей «металличности» элемента: чем меньше потенциал ионизации, чем легче оторвать электрон от атома, тем сильнее должны быть выражены металлические свойства элемента. Так потенциалы ионизации у щелочных металлов имеют меньшие значения, чем у элементов подгруппы меди, значит, металлические свойства щелочных металлов выражены в большей степени, чем меди и серебра.
б) В главных подгруппах радиусы атомов элементов одинаково возрастают с увеличением заряда ядра. Кроме того, увеличение числа электронных слоёв, промежуточных между ядром атома и внешними электронами, приводит к более сильному экранированию ядра, т.е. к уменьшению его эффективного заряда. Оба эти фактора (растущее удаление внешних электронов от ядра и уменьшение его эффективного заряда) приводит к ослаблению связи внешнего электрона с ядром и, следовательно, к уменьшению потенциала ионизации.
У элементов подгруппы меди тоже наблюдается возрастание атомного радиуса, но в месте с тем, при увеличении заряда ядра и количества электронов, происходит усиление электростатического взаимодействия между ядром и электронами, что приводит к большему укреплению связи внешнего электрона с ядром, т.е. к увеличению потенциала ионизации.
Задача 198.
Одинакова ли энергия ионизации атома цезия и атома лития, у которого валентный электрон предварительно возбужден на 6s-подуровень? Ответ обосновать.
Решение:
У атомов лития и цезия на внешнем электронном слое находится по одному s-электрону, только у атома лития s-электрон находится на втором энергетическом уровне (2s1), а у цезия – на шестом (6s1). Заряды ядер атомов лития и цезия, соответственно составляют +3 и +55. При возбуждении валентного электрона атома лития на 6s-подуровень, атом лития приобретает шесть энергетических уровней. При этом заряд ядра его атома не изменяется, а остаётся прежним +3, но объём атома существенно увеличивается. Что приводит к уменьшению связи внешнего электрона с ядром и, соответственно, к уменьшению энергии ионизации I1.
Хотя возбуждённый атом лития, как и атом цезия, содержит валентный электрон на шестом энергетическом уровне, энергии ионизации I1 их атомов будут иметь различные значения, потому что у них разные заряды и разное число электронов и, следовательно, различное электростатическое взаимодействие этих электронов с ядром атома. Очевидно, что при малом заряде ядра атома лития, энергия ионизации I1 атома возбуждённого лития будет иметь меньшее значение, чем атома цезия.
Задача 199.
Как изменяется с ростом порядкового номера значение первого потенциала ионизации у элементов второго периода? Чем объяснить, что первый потенциал ионизации атома Ве больше, чем атомов Li и В?
Решение:
В пределах периода с увеличением порядкового номера элемента (Z) имеет место тенденция к уменьшению размеров атомов. Это объясняется увеличивающимся притяжением электронов внешнего слоя к ядру по мере возрастания его заряда. Закономерно с уменьшением радиуса атомов (ra) в периоде возрастает потенциал ионизации (I1) атомов элементов второго периода. Но увеличение потенциала ионизации у элементов II-го периода происходит неравномерно. Так у атома лития потенциал ионизации I1 наименьший, потому что радиус его атома наибольший и, поэтому 2s1-электрон легко отрывается от атома, кроме того, 1s-электронное облако первого уровня экранирует ядро и снижает эффективный заряд (Zэф). При переходе к бериллию эффект экранирования остаётся прежним и значения Zэф и I1 растут. К тому же у атома бериллия полностью завершается заполнение электронами 2s-подуровня и возникает новый электронный экран, который лишь немного снижает у атома бора. Так как 2s- и 2p-подуровни имеют приблизительно одинаковые значения энергии, то появление нового p-подуровня у атома бора приводит лишь к незначительному снижению потенциала ионизации I1 и эффективного заряда ядра Zэф.Далее у атомов углерода и азота, по мере заполнения 2p-орбиталей электронами (по одному на каждой орбитали), происходит рост Zэф и I1.
У атома кислорода начинается заполнение 2p-орбиталей вторыми электронами со спином ms = -1/2. Энергия взаимного отталкивания двух электронов в небольшом объёме гантелевидного 2p-облака проявляется в уменьшении I1. Затем снова идёт рост I1 и Zэф по мере заполнения 2p-орбиталей вторыми электронами у атомов фтора и неона. После завершения 2p-подуровня (атом Ne) I1 приобретает максимальное значение у элементов II-го периода, расположенных в конце периода.
Таким образом, при завершении заполнения 2s-подуровня потенциал I1 возрастает, при начале заполнения электронами 2p-подуровня первым электроном, т.е. при появлении нового подуровня I1 уменьшается, а затем возрастает до заполнения p-орбиталей по одному электрону (у B, C, N). Затем, значение I1 снова уменьшается при начале заполнения 2p-орбиталей вторыми электронами (О) и, увеличивается до полного заполнения 2p-орбиталей (F и Ne).
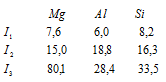
Задача 200. Объяснить ход изменения энергии ионизации (эВ) в ряду Mg – Al –Si
Решение:
Магний на внешнем электронном слое содержит два 3s-электрона, алюминий – три электрона (два 3s и один 3p), кремний – четыре электрона (по два 3s и 3p). По мере последовательного отрыва электронов от атомов положительный заряд образующихся ионов возрастает. Поэтому для удаления каждого последующего электрона требуется большая затрата энергии, так что последовательные энергии ионизации атома (I1, I2, I3) возрастают, что и наблюдается у атомов Mg, Al и Si. Особенно резко возрастает энергия ионизации при отрыве электрона с главным квантовым числом меньше, чем у предыдущего электрона. Так в случае Mg (3s2) разность между I1 и I2 много меньше, чем между I2 и I3. У Al и Si этой закономерности не наблюдается, так как у Al (3s23p1) и у Si (3s3p4) все три электрона находятся на одном энергетическом уровне.
Энергия ионизации I1 у алюминия меньше, чем у магния. Объясняется это тем, что при переходе от Mg к Al начинается заполнение электронами нового 3p-подуровня, т.е. возникает новый электронный экран, который немного снижает I1 у атома Al, так как 3s- и 3p-электронные облака имеют приблизительно одинаковые размеры. Далее у атома Si происходит рост.
Энергия ионизации I2 с ростом Z атомов элементов в периоде, с уменьшением их радиусов, закономерно увеличивается, так как вторые электроны у магния и алюминия с одинаковыми квантовыми показателями (3s-электроны). У кремния I2 уменьшается, так как возникает новый электронный экран, причём это уменьшение незначительно, потому что 3s- и 3p-орбитали лишь немного разнятся по энергии между собой.
Энергия ионизации I3 у магния наибольшая, чем у алюминия и кремния. Объясняется это тем, что у атома магния третий электрон, который отрывается, имеет меньшее значение главного квантового числа (n + l = 2), чем у алюминия и кремния (n + l = 3). Наименьшее значение I3 у алюминия объясняется тем, что отрывается 3s-электрон и образуется устойчивый ион Al3+ с конфигурацией электронов атома Ne, являющейся энергетически более устойчивой системой, чем Mg3+ и Si3+. У кремния наблюдается незначительный рост I3 по отношению к атому алюминия, так как радиус атома кремния меньше, чем у алюминия.

