Решение некоторых типов задач по общей химии
Реакции оксида лития и хлорид диамминсеребра (I)
Задача 491.
№1. С чем не взаимодействует оксид лития? 1. вода, 2. оксид магния, 3. нитрат кальция, 4. соляная кислота, 5 оксид серы (4), 6. фосфорная кислота, 7. гидроксид бария. В ответе укажите номера в порядке возрастания.
№2. Из нитрата бария выпадает осадок при добавлении:
1. CaCO3, 2. K2CO3, 3. KCL, 4. KNO3.
№3. Атом элемента имеет на 10 электронов меньше, чем ион галлия Ga3+. Этот элемент:
1. фосфор, 2. сера, 3. хлор, 4. аргон.
№4. Укажите степень окислителя в химической реакции, схема которой: NaClO + CrCL3 + NaOH = NaCl + Na2CrO4 + H2O.
№5. Какая масса углекислого газа выделится при термическом разложении 10 г известняка?
№6. Качественной реакцией на ион кальция является...
Решение:
№1.
Оксид лития Li2O не взаимодействует с оксидом магния (2) и гидроксидом бария (7), потому что MgO основной оксид, а Ва(ОН)2 - основание. Основные оксиды не взаимодействуют с основаниями и основными оксидами. Li2O не реагирует с Сa(NO3)2 (3), потому что не образуется летучее соединение.
Ответ: 2, 3, 7.
№2
Ba(NO3)2 + K2CO3 = BaCO3 + 2KNO3.
Выпадает осадок малорастворимого соединения карбоната бария.
№3.
Электронная формула иона: Ga3+- 1s2 2s2 2p6 3s2 3p6 4s2 3d8 4p0.
Если отнять 10 электронов, то получится - 1s2 2s2 2p6 3s2 3p6, что соответствует аргону -
Ar - 1s2 2s2 2p6 3s2 3p6.
№4.
В NaClО степень окисления окислителя +1 (Сl+1).
№5
Уравнение реакции имеет вид:
СаСО3 = СаО + СО2.
Из уравнения реакции вытекает, что из 1 моль карбоната кальция выделяется 1 моль углекислого газа, т.е. n(СаСО3) = n(СО2).
n(СаСО3) = m(СаСО3)/MСаСО3) = 10/100 = 0,1 моль;
n(СО2) = n(СаСО3) = 0,1 моль.
Тогда
m(СО2) = n(СО2) . M(СО2) = 0,1 . 44 = 4,4 г.
№6
Качественная реакция на ион Са2+:
CaCl2 + (NH4)2CO3 → CaCO3 + 2NH4Cl.
Задача 492.
Что образуется при взаимодействии [Ag(NH3)2]Cl с NaOH? Будет образовываться AgOH, NaCl, NH3 или другие вещества? Какой цвет имеет [Ag(NH3)2]Cl?
Решение:
Kнест.[Ag(NH3)2](+) = 9,3 ⋅ 10^-8.
Комплексная соль [Ag(NH3)2]Cl диссоциирует в две ступени:
I ступень. Диссоциация на комплексный ион и ион внешней сферы:
[Ag(NH3)2]Cl ⇔ [Ag(NH3)2](+) + Cl(-).
II ступень. Диссоциация (распад) компл. иона:
[Ag(NH3)2](+) ⇔ Ag(+) + 2NH3.
В водном растворе Комплексная соль [Ag(NH3)2]Cl диссоциирует в основном по 1-й ступени.
Гидроксид натрия NaOH в водном растворе диссоциирует практически полностью:
NaOH = Na(+) + OH(-).
Таким образом, при смешении растворов [Ag(NH3)2]Cl и NaOH, в системе будут присутствовать ионы:
[Ag(NH3)2](+), Cl(-), Na(+) и OH(-),
которые не будут связываться друг с другом. Значит, при смешении растворов [Ag(NH3)2]Cl и NaOH реакция не протекает.
Ион серебра Ag+ имеет электронную конфигурацию (… 4d10). Все 4d – орбитали заполнены, и переход электронов с 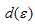 на
на 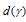 на
на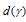 подуровень невозможен.
подуровень невозможен.
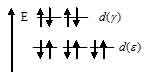
Составление элктронных форму элементов
Задача 493.
По положению атома элемента в Периодической системе (As(мышьяк) и Hf(гафний)):
а) составьте электронные формулы заполнения электронами валентных орбиталей атомов элементов в нормальном и возбуждённом состояниях;
б) определите, к каким электронным свойствам они относятся, какие свойства проявляют.
Решение:
1. Электронные формулы элементов
а) As(мышьяк)
Элемент № 33 - мышьяк (As – порядковый № 33) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р3 - (нормальное состояние);
1s2 2s2 2p6 3s2 3p6 4s1 3d10 4р3 4d1 - (возбужденное состояние).
Валентные электроны мышьяка (4s2 3d10 4р3) - находятся на 4s-, 3d- и 4р-подуровнях. На валентных орбиталях атома As находится 15 электронов. Поэтому элемент помещают в пятнадцатую группу периодической системы Д. И. Менделеева. Мышьяк относится к d-элементам.
Наличие трех неспаренных электронов свидетельствует о том, что мышьяк способен проявлять валентность III (низшая валентность) в своих соединениях (As2O3, AsH3, HAsO2, H3AsO3).
Для атома мышьяка характерно наличие возбужденного состояния из-за того, что орбитали 4d-подуровня являются вакантными (на четвертом энергетическом слое помимо 4s- и 4p-подуровней есть еще и 4d-подуровень). Электроны 4s-подуровня распариваются и занимают свободную орбиталь 4d -подуровня. Наличие пяти неспаренных электронов в возбужденном состоянии свидетельствует о том, что мышьяк также проявляет в своих соединениях валентность V (H3AsO4, As2O5) (высшая валентность).
Мышьяк имеет степени окисления +5, +3, 0 и -3, т. е. может проявлять как окислительные, так и восстановительные свойства.
б) Hf(гафний)
Для элемента № 72 - гафний (Hf – порядковый № 72) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d2 - (нормальное состояние);
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s1 4f14 5d2 6р1 - (возбужденное состояние).
Валентные электроны гафния (6s2 5d2) - находятся на 6s- и 5d-подуровнях. На валентных орбиталях атома Hf находится 4 электрона. Поэтому элемент помещают в четвертую группу периодической системы Д.И. Менделеева. Гафний относится к d-элементам.
При возбуждении атома гафния один электрон с 6s- подуровня переходит на 6р-подуровень, то при этом в атоме гафния образуются 4 неспаренных электрона: 2 на 5d-подуровне, 1 электрон на 6s- подуровне и 1 на 6р-подуровене. Гафний проявляет валентность равную 2, 3 и 4.
Степени окисления гафния: 0, +2, +3, +4, поэтому гафний - восстановитель.
Определение типа гибридизации атома элемента в ионе
Задача 494.
По какому типу проходит гибридизация атома серы в сульфат-ионе?
Решение:
В серной кислоте атом серы проявляет степень окисленности +6, т.е. в образовании химических связей будут участвовать все 6 электронов атома серы. Но это возможно только, если атом серы находится в возбужденном состоянии - когда все 6 электронов находятся по одному в ячейках орбиталей (у серы (3s23p43d0) осуществляется переход двух электронов на 3d-подуровень). Электронная формула возбужденного атома серы в серной кислоте будет иметь вид: 1s22s22p63s1p33d2, т.е. валентные электроны - 3s1p33d2.
Нужно исходить из того сколько и какие электроны участвуют в образовании связей в молекуле (ионе).
В группе SO42- атом серы соединяется с четырьмя атомами кислорода, где сера проявляет ковалентность равную 6.
Строим структурную формулу SO42-, соблюдаем валентности атомов серы и кислорода:
O-Н
|
O=S=O
|
O-Н
Из структурной формулы вытекает, что в сульфат-ионе атом серы соединен с 4-мя атомами кислорода, из которых два атома кислорода соединены с атомом водорода, а два атома кислорода - соединены только с атомом серы. Между двумя атомами возможна только одна сигма-связь.
Теперь, просто посчитаем связи в сульфат-ионе, получим: 4 сигма-связи; 2 пи-связи. Считать нужно только сигма-связи, значит в образовании связей в ионе участвуют четыре атомные орбитали, это одна s- и три р-орбитали, значит гибридизация атома серы проходит по sр3 типу.
Таким образом в SO42- четыре гибридных электрона расположенных на одной s- и трех p-орбиталях (s1р3) образуют 4 сигма-связи, эти электроны участвуют в гибридизации, а два неспаренных электрона в d-орбиталях будут образовывать две пи-связи между двумя атомами кислорода.
Определение массы проукта реакции
Задача 495.
Определите массу метанола, которую можно получить из 11,2 м3 оксида углерода (II) и 40 м3 водорода (н. у.), если выход продукта реакции равен 75%.
Решение:
Уравнение реакции имеет вид:
СО + 2Н2 → СН3ОН.
Из уравнения реакции вытекает, что на получение метанола требуется 1 моль СО и 2 мол Н2, т.е. n(CO) = 2n(H2).
Определим избыток взятого вещества для реакции:
n(CO) = [V(CO)/Vm] . 1000 = (11,2/22,4) . 1000 = 500 моль;
n(Н2) = [V(Н2)/Vm] . 1000= (40/22,4) . 1000 = 1785,7 моль.
Так как
n(CO) : 2n(H2) - 1 : 2, а
500 : 1785,7 = 1 : 2,57, то в избытке взят водород, значит расчет продукта реакции метанола будем проиводит по СО.
Отсюда
m(СН3ОН) = n(СН3ОН) . M(СН3ОН) = 500 моль . 32 г/моль = 16000 г ИЛИ 16 кг.
Определите массу метанола с учетом выхода продукта реакции, получим:
mпрод.(СН3ОН) = m(СН3ОН) . h = 16 . 0,75 = 12 кг.
Ответ: mпрод.(СН3ОН) = 12 кг.
Определение количества молекул вещества
Задача 496.
Определите количество молекул которое содержится в 1 граме каждого из веществ СО2, СаО и Н2О.
Решение:
Найдем молярные массы:
M(CO2) = 12 + (16 × 2) = 44 г/моль;
М(СаО) = 40 + 16 = 56 г/моль;
М(Н2О) = (1 × 2) + 16 = 18 г/моль.
Рассчитаем количество частиц веществ по формуле:
N = m × Na/M, где
m - масса вещества (1 грамм), Na - постоянная Авогадро.
Отсюда
N(CO2)= 1 × 6 . 1023/44 = 1,36 . 1022 молекул;
N(CaO) = 1 × 6 . 1023/56 = 1,07 . 1022 молекул;
N(H2О) = 1× 6 . 1023/56/18 = 3,33 . 1022 молекул.

