Электронные формулы атомов элементов кальция, неона, хрома, мышьяка, германия, молибдена, титана
Задание 36
Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента неверны: а) 1s22s22p53s1; б) 1s22s22p6; в) 1s22s22p63s23р63d4; г) 1s22s22p63s23р64s2;
д) 1s22s22p63s23d2? Почему? Атомам каких элементов отвечают правильно составленные электронные формулы?
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали (АО) могут находиться не более двух электронов, различающихся своими спинами ms = 1/2. Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО. Исходя из этого, на s-подуровне максимальное число электронов может быть равно двум [2 (2 . 0 + 1) = 2], на р-подуровне – трём [2 (2 . 1 + 1) = 6], на d-подуровне - [2 (2 . 2 + 1) = 10], на f-подуровне - [2 (2 . 3 + 1) = 14]. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→
→6s→(5d1)→4f→5d→→6p→7s→(6d1-2)→5f→6d→7p.
Исходя из этого неверными электронными формулами будут: а) 1s22s22p53s1, потому что прежде, чем начнётся заполнение 3s-подуровня, сначала должен быть полностью заполнен 2р-подуровеь, т.е. запись 2р5 неверна (должно быть 2р6); в) 1s22s22p63s23р63d4 - после 3р-подуровня должно идти заполнение 4s-подуровня; д) 1s22s22p63s23d2, потому что после заполнения 3s-подуровня должно идти заполнение 3р-подуровня.
Формула б) 1s22s22p6 отвечает электронному строению атома неона (+10Ne), а формула г) 1s22s22p63s23р64s2 – отвечает строению атома кальция (+20Са).
Задание 37.
Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33, учитывая, что у первого происходит «провал» одного 4s—электрона на 3d—подуровень. Чему равен максимальный спин d-электронов у атомов первого и р-электронов у атомов второго элемента?
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали (АО) могут находиться не более двух электронов, различающихся своими спинами ms = 1/2. Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО. Исходя из этого, на s-подуровне максимальное число электронов может быть равно двум [2 (2 . 0 + 1) = 2], на р-подуровне – трём [2 (2 . 1 + 1) = 6], на d-подуровне - [2 (2 . 2 + 1) = 10], на f-подуровне - [2 (2 . 3 + 1) = 14]. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→
→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→6d→7p.
Так как число электронов в атоме элемента равна его порядковому номеру в периодической системе химических элементов таблицы Д. И. Менделеева, то для элементов 24 (хром) и 33 (мышьяк) электронные формулы будут иметь вид:
а) +24Cr 1s22s22p63s23p63d54s1.
У атома хрома один 4s-электрон перешёл на 3d-подуровень, потому что энергетически выгоднее состояние когда все пять АО 3d-подуровня заполнены по одному электрону:
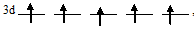
чем состояние 3d-подуровня с одной незанятой АО:
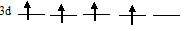
б) +33Аs 1s22s22p63s23p63d104s24p3.
У атома хрома на 3d-подуровне содержится пять неспаренных электронов каждый со спинами ms = +1/2, поэтому максимальный спин d-электронов атома хрома равен сумме всех спинов пяти электронов (макс.) ms = +2,5. У атома мышьяка 4р-подуровне расположены три неспаренных электрона со спинами ms = +1/2 каждый, поэтому максимальный спин 4р-электронов атома мышьяка равен сумме спинов всех трёх электронов, получим: (макс.) ms = +1,5.
Задание 39.
В чем заключается принцип Паули? Может ли быть в каком-нибудь подуровне атома р7 - или d12- электронов? Почему? Составьте электронную формулу атома эле-мента с порядковым номером 22 и укажите его валентные электроны
Решение:
В атоме не может быть двух электронов с одинаковыми значениями всех четырёх квантовых чисел. Этот принцип сформулирован в 1925 году швейцарским физиком В. Паули.
Принцип Паули определяет прежде всего максимальную ёмкость по электронам одной орбитали Nm. Так как орбиталь определяется тремя первыми квантовыми числами (n, l, ms), электроны данной орбитали могут различаться только спином квантовым числом ms. Оно может приобретать только два значения: -1/2 и +1/2, поэтому максимальная ёмкость любой орбитали Nm = 2, т. е. на ней могут находиться два электрона, один электрон или же она может быть вакантной, пустой.
Это же принцип определяет электронную ёмкость подуровней, уровней. Подуровень l имеет (2l + 1)-орбиталь, на каждой из которых может быть не больше двух электронов, поэтому предельная, максимальная ёмкость подуровня Nl равна:
Nl = 2(2l + 1).
Максимальная ёмкость уровня по электронам (Nn) равна:
Nn = 2n2.
Так как p-подуровень содержит три АО, то на нём максимально может находиться 6 электронов согласно уравнению Nl = 2(2l + 1) = 2(2 . 1 +1) =6, то запись р7 неверна. На d-подуровне согласно уравнению Nl = 2(2l + 1) может находиться максимально 10 электронов Nl = 2(2l + 1) = 2(2 . 2 +1) =10, поэтому запись d12 неверна.
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→
→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→6d→7p.
Так как число электронов в атоме элемента равно его порядковому номеру в таблице химических элементов Д. И. Менделеева, то для элементов №22 (титан электронная формула имеют вид:
+22Ti 1s22s22p63s23p63d242
На внешнем энергетическом уровне атома титана содержится два валентных 4s-электрона:
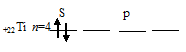
Задание 40.
Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит «провал» одного 5s-электрона на 4d-подуровень. К какому электронному семейству относится каждый из элементов?
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→
→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→6d→7p.
Так как число электронов в атоме элемента равно его порядковому номеру в таблице химических элементов Д. И. Менделеева, то для элементов №32 (германий) и №42 (молибден) электронные формулы имеют вид:
+32Ge 1s22s22p63s23p63d104s24p2;
+42Mo1s22s22p63s23p63d104s24p64d55s1.
У атома элемента №42 (молибден) электрон с 5s-подуровня «провалился» на 4d-подуровень. Этим самым все пять АО на 4d-подуровне содержат по одному электрону, потому что энергетически выгоднее состояние когда все пять АО 4d-подуровня заполнены по одному электрону:
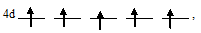
чем состояние 4d-подуровня с одной незанятой АО:
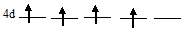
Германий на внешнем энергетическом уровне содержит два 4s-электрона и два 4р-электрона, поэтому относится к семейству р-элементов. Атом молибдена на внешнем энергетическом уровне содержит один валентный электрон на 5s-подуровне и, в качестве валентных электронов могут выступать электроны предшествующего 4d-подуровня, по-этому относится к семейству d-элементов.

