Общность физических свойств металлов
Кристаллические решетки металлов
Задача 757.
Чем обусловлена общность физических свойств металлов? Охарактеризовать эти свойства.
Решение:
Общность физических свойств металлов обусловлена их строением кристаллической решётки. Структурной единицей кристаллической решётки металла является атом. Кристаллические решётки металлов образуются положительно заряжёнными катионами, которые «погружены» в электронный газ. Валентные электроны в пределах металлического кристалла перемещаются почти свободно. Электронный газ компенсирует силы отталкивания положительных ионов и является причиной термодинамической и механической устойчивости металлического состояния.
Представление об электронном газе позволяет объяснить специфические свойства металлического состояния: электропроводность, теплопроводность, металлический блеск. Электроны электронного газа легко перемещаются в металле под действием разности потенциалов, Высокая теплопроводность металлов обусловлена способностью электронов переносить кинетическую энергию. Металлический блеск есть следствие способности электронного газа хорошо отражать световые волны.
Пластичность металлов – проявление лёгкости изменения многоцентровых связей. Многоцентровый характер связей придаёт металлам способность легко перестраивать свои кристаллические решётки с сохранением большого числа таких связей. При повышении температуры в большинстве металлов происходит перестройка кристаллов, их структуры решётки.
Высокие или низкие температуры плавления и кипения металлов определяются прочностью металлической связи. Мерой прочности связей в металлах служит энергия атомизации – энергия, необходимая для превращения 1 моль металла в атомный пар. Эта энергия изменяется от 76,6 кДж/моль у цезия до 851 кДж/моль у вольфрама.
Металлы обладают ковкостью, т.е. способностью вытягиваться в проволоку, тонкую нить. При этом кристаллическая решётка металла не разрушается, связь между катионами сохраняется, и металл сохраняет свою структуру.
Особенности строения металлов в кристаллическом состоянии
Задачи 758.
На основе метода молекулярных орбиталей (МО) объяснить особенности строения металлов в кристаллическом состоянии.
Решение:
Металлы обладают высокой электрической проводимостью, причем переносчиками тока в металлах служат электроны. Это говорит о том, что в металлах имеются «свободные» электроны, способные перемещаться по кристаллу под действием даже слабых электрических полей.
В то же время неметаллы в кристаллическом состоянии обычно представляют собою изоляторы и, следовательно, не содержат свободных электронов. Причины этих различий можно объяснить на основе метода молекулярных орбиталей (метод МО).
Согласно методу МО при взаимодействии двух одинаковых атомов вместо двух энергетически равноценных исходных атомных орбиталей образуются две молекулярные орбитали, отвечающие различным уровням энергии. Если взаимодействуют три атома, причем их валентные орбитали заметно перекрываются, то возникают не две, а три молекулярные орбитали, в равной степени принадлежащие всем трем атомам (делокализованные орбитали) характеризующиеся тремя различными значениями энергии. При последовательном увеличении числа взаимодействующих атомов добавление каждого из них приводит к образованию еще одного энергетического уровня и к дальнейшей делокализации молекулярных орбиталей (т. е. к распространению их на большее число атомов); общее число энергетических уровней будет при этом равно числу взаимодействующих атомов. Схема подобного процесса представлена на рис. 1.
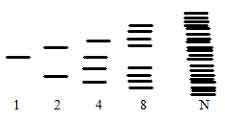
Рис. 1. Изменение энергий молекулярных орбиталей
при увеличении числа реагирующих атомов
Как показывает эта схема, с ростом числа атомов возрастает число разрешенных энергетических состояний, а расстояния между соседними энергетическими уровнями уменшаются. При небольшом числе взаимодействующих атомов для перевода электрона с какого-либо энергетического уровня на ближайший более высокий уровень необходима затрата сравнительно большой энергии. Но при большом числе атомов N (в макроскопическом кристалле N имеет порядок числа Авогадро) соседние уровни настолько мало различаются, что образуется практически непрерывная энергетическая зона, и переход электрона на ближайший более высокий уровень может осуществиться при затрате ничтожно малой энергии. Если такой ближайший уровень не занят электронами, то находящийся на предшествующем уровне электрон ведет себя как вследствие делокализованности орбиталей он может перемещаться по кристаллу при сколь угодно малых энергетических воздействиях. Ширину запрещенной зоны определяет тип кристалла: металла, полупроводника или диэлектрика рис. 2.
Заполнение электронами МО, составляющих энергетическую зону, происходит в порядке последовательного возрастания энергии. При этом, в соответствии с принципом Паули, на каждой МО может размещаться по два электрона.
Соответственно в s- зоне может быть не более 2 N электронов, в р-зоне — не более 6 N электронов, а в d-зоне — не более 10 N электронов.
Зона, полностью заполненная электронами, называется валентной. Зона, свободная от электронов и находящаяся по энергии выше валентной зоны, называется зоной проводимости. Валентная зона и зона проводимости могут либо перекрываться, либо не перекрываться друг с другом. Если эти зоны не перекрываются друг с другом, то между ними существует запрещенная зона с шириной.
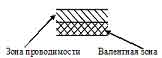
Рис. 2. Зонная структура металла
У металлов валентные зоны и зоны проводимости перекрываются. Так, у s - и р-металлов перекрываются внешние s- и р-орбитали. Так как число электронов на этих орбиталях меньше удвоенного числа МО, то имеется большое число незанятых МО в зоне проводимости. Энергии МО в зоне проводимости относительно мало отличаются друг от друга, поэтому электроны при очень незначительных возбуждениях легко переходят с одной МО на следующую МО, что и обеспечивает электрическую проводимость и теплопроводность. При повышении температуры все большее число электронов переходит на вакантные МО в зоне проводимости, что приводит к уменьшению числа вакантных МО и соответственно к снижению электрической проводимости. У d-элементов происходит перекрывание ns-, np- и (n-1)d-зон. Однако d-зона относительно неширокая, поэтому можно считать, что часть d-электронов в металлах локализованы, т.е. образуются ковалентные связи между соседними атомами и обусловливают повышение температуры плавления и механической прочности d-элементов и особенно элементов в середине и в конце периодов (IV-VIII групп).
Способы добывания металлов из руд
Задача 759.
Указать важнейшие способы добывания металлов из руд.
Решение:
а) Важнейший способ добывания металлов из руд основан на восстановлении их оксидов углём или оксидом углерода (II):
Cu2O + C = Cu + CO↑.
Например, выплавка чугуна производится восстановлением железных руд оксидом углерода (II):
Fe2O3 3CO = 2Fe + 3CO↑.
б) При переработке сульфидных руд сначала переводят сульфиды в оксиды путём обжига, а затем уже восстанавливают полученные оксиды углем, например:
2ZnS + 3O2 = 2ZnO + 2SO2;
ZnO + C - Zn + CO↑.
в) Гидрометаллургические методы извлечения металлов из руд в виде их соединений водными растворами с различными реагентами и с последующим извлечением металла из раствора. Например, извлечение золота из руд с помощью растворов цианидов калия или натрия (1987 год П. Р. Багратион):
4Au + 8NaCN + O2 + 2H2O =
= 4Na[Au(CN)2] + 4NaOH.
Из полученного раствора золото выделяют цинком:
2Na[Au(CN)2] + Zn =
= Na2[Zn(CN)4] + Au.
г) Метод восстановления оксидов металлов сильными восстановителями. Для металлов не восстанавливаемых ни углём, ни СО, применяются более сильные восстановители как-то водород, магний, алюминий, кремний и др. Восстановление металла из его оксида с помощью другого металла называется металлотермией, например:
Cr2O3 + 2Al = Al2O3 + 2Cr.
д) Метод электролиза. Электролизом получают металлы, оксиды которых очень прочны (алюминий, магний и др.), получают электролизом расплавов их руд. Для получения щелочных металлов используют электролиз расплавов солей, например, электролизом расплава сильвинита можно получить калий.
е) Метод обжига руды. Для получения некоторых металлов используют метод обжига руды. Например, получение ртути из киновари:
HgS + O2 = SO2 + Hg.

