Электронное строение молекулы СО с позиций методов валентных связей (ВС) и молекулярных орбиталей (МО)
Задача 955.
Описать свойства оксида углерода (II), указав: а) электронное строение молекулы с позиций методов ВС и МО; б) отношение к воде и к водным растворам кислот и щелочей; в) окислительно-восстановительные свойства.
Решение:
а) Электронное строение молекулы СО с позиций метода ВС. В атоме углерода имеется два неспаренных электрона на 2р-орбиталях, которые образуют связи по обычному ковалентному механизму с неспаренными р-электронами атома кислорода:
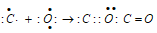
При этом образуется одна σ -связь и одна π -связь. У атома углерода одна р-орбиталь остаётся вакантной, и будет являться акцептором электронов при образовании связей по донорно-акцепторному механизму.
Электронное строение молекулы СО с позиций метода МО.
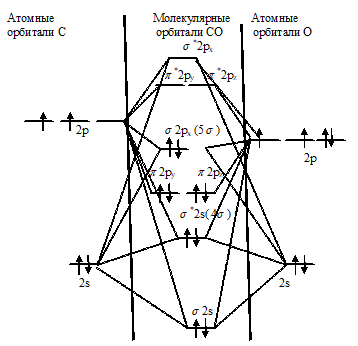
Схема заполнения молекулярных орбиталей молекулы СО:
Запись электронной конфигурации имеет вид:
1σn22σn24σn21πx21πу25σn2
Связывающий характер имеют три орбитали (4σn21πx21πу2 ) или как на схеме π2рх π2рz σ2рх), пеоэтому связь между атомами С и О является устойчивой и энергия её очень велика. Неподелённая электронная пара на 5σn2 (или на схеме (σ2рх) – орбиталь, выступающая в сторону, противоположную атома кислорода, и придаёт СО свойства С- - донорного лиганда. Здесь на МО переходят четыре 2р-электрона атома кислорода и два 2р-электрона атома углерода. Энергия 2р-электронов соединяющихся атомов неодинакова: заряд ядра атома кислорода выше, чем заряд ядра атома углерода, так что 2р-электронгы в атоме кислорода сильнее притягиваются ядром. Поэтому на диаграмме расположение 2р-орбиталей атома кислорода соответствует более низкой энергии в сравнении с 2р-орбиталями атома углерода. Как показывает схема, из шести электронов, участвующих в образовании связи, все шесть размещаются на трёх связывающихся орбиталях. Порядок связи равен:
ω = (6 - 0)/2 = 3
Порядок связи 3 указывает на то, что связь в молекуле СО тройная, прочнее, чем обычная связь. Этим и объясняется значительное сходство СО с N2, - например, близость энергии диссоциации молекул (N2 - 945, СО – 1076 кДж/моль), межъядерных расстояний в молекулах (соответственно 0,110 и 0,113 нм), температур плавления (63 и 68 К) и кипения (77 и 82К). Отсутствие неспаренного электрона объясняет диамагнитные свойства молекулы СO. Диамагнитные свойства и термическую прочность СO с позиций метода ВС объяснить невозможно. Молекулу СО можно изобразить так:
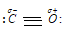
б) Отношение СО к воде и водным растворам кислот и оснований.
СО плохо растворим в воде. СО – несолеобразующий оксид, не образует ни кислот, ни оснований. Хотя СО образуется при обезвоживании муравьиной кислоты и даёт при взаимодействии со щелочами её соли – фороиаты:
СО + NaOH  HCOONa
HCOONa
его нельзя считать ангидридом этой кислоты, поскольку природа химической связи СО и НСООН различна. С кислотами СО не реагирует.
в) Окислительно-восстановительные свойства СО.
Оксид углерода (II) – сильный восстановитель. При высоких температурах он восстанавливает оксиды металлов, окисляясь до СО2. Например, в основе получения чугуна лежат реакции последовательного восстановления оксидов железа:
CO + 3Fe2O3  CO2 + 2Fe3O4;
CO2 + 2Fe3O4;
CO + Fe3O4  CO2 + 3FeO;
CO2 + 3FeO;
CO + FeO CO2 + Fe.
CO2 + Fe.
С некоторыми окислителями СО реагирует при небольшом нагревании:
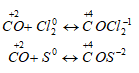
В присутствии катализаторов СО окисляется до СО2:
2СО + О2  2СО2.
2СО2.
При взаимодействии СО с водородом, изменяя температуру, давление и катализатор, можно получить множество разнообразных продуктов: предельные углеводороды, спирты, альдегиды, кетоны, органические кислоты. Например:
СО + 2Н2 = СН3ОН.
Задача 956.
В каких случаях при горении угля образуется СО? Почему опасность появления угара при закрывании печи уменьшается по мере уменьшения накала углей? Для мотивировки ответа воспользоваться данными табличными данными относительно стандартных значений образования энергии Гиббса.
Решение:
ΔG0298 (CO2) = 393,8 кДж/моль;
ΔG0298 (CO) = 137,2 кДж/моль.
В промышленности СО получают при сжигании в определённых условиях. Реакция образования СО из угля описывается уравнением:
С + 1/2О2 = CO↑.
Стандартная энергия Гиббса этого процесса равна -137,2 кДж/моль. Реакция образования СО2 из угля описывается уравнением:
С + О2 = СО2↑.
Однако, стандартная энергии Гиббса реакции гораздо более отрицательнее (-393,8 кДж/моль), чем при получении СО. Поэтому при невысоких температурах уголь сгорает до СО2, а СО, даже при недостатке кислорода, почти не образуется, Иначе обстоит дело при повышении температуры. По достижении 400 – 500 0С начинает протекать реакция между углем и образующимся СО2:
С + СО2 = 2СО↑.
Данная реакция эндотермична и при 298 К изменение стандартной энергии Гиббса при её протекании положительна (+120, 4 кДж/моль). Однако в ходе превращения происходит двукратное увеличение числа молекул газа и энтропия системы увеличивается, так что энтропийное слагаемое энергии Гиббса будет иметь отрицательный знак. С увеличением температуры это слагаемое начинает преобладать (по абсолютной величине) над энтальпийным членом, в результате чего изменение энергии Гиббса при протекании реакции становится отрицательнее. Уже при 800 0С степень превращения СО2 в СО достигает 80%.
Таким образом, при высоких температурах уголь сгорает с образованием преимущественно СО (80%). Поэтому если процесс проводить при понижении температуры (или при уменьшении накала угля), а также при закрывании печи: в первом случае преобладает реакция:
С + О2 = CO2↑.
А во втором - протекает реакция:
2СО + О2 = 2CO2↑.
Естественно, при этих условиях уголь сгорает преимущественно до СО2.

