Характеристика ионов водорода. Энергетические схемы образования молекулярных орбиталей ионов
Задача 805.
Какие из перечисленных атомов, ионов и молекул диамагнитны: а) Н; б) Н2–; в) H2; г) H22–?
Зешение:
а) Атом Н имеет на внешнем энергетическом уровне один электрон (1s1) вследствие чего суммарный спин отличен от нуля - атом парамагнитен.
б) Энергетическая схема образования молекулярных орбиталей иона Н2– имеет вид:
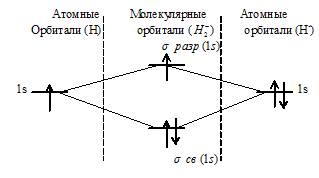
При образовании H2- из атома водорода и иона Н- образуется молекулярная орбиталь на которой содержится два электрона на связывающей орбитали и один на разрыхляющей, суммарный спин отличен от нуля, что и придаёт частице парамагнитные свойства.
в) Энергетическая схема образования молекулярных орбиталей H2 имеет вид:
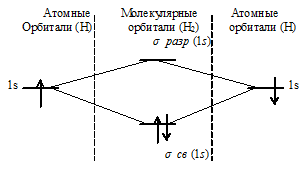
При образовании Н2 из двух атомов водорода образуется молекулярная орбиталь на которой содержится два электрона на связывающей орбитали. Неспаренных электронов нет, значит, суммарный спин электронов равен нулю - частица диамагнитна.
г) Энергетическая схема образования молекулярных орбиталей иона H22– имеет вид:
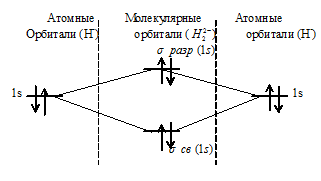
При образовании H22- из двух ионов Н- образуется молекулярная орбиталь на которой содержится два электрона на связывающей орбитали и два на разрыхляющей, суммарный спин электронов равен нулю - частица диамагнитна.
Ответ: б3.
Задача 806.
Гремучая смесь при комнатной температуре: а) находится в состоянии химического равновесия; б) не находится в состоянии химического равновесия? Потому что: 1) скорость реакции равна нулю; 2) внесение катализатора приводит к протеканию реакции.
Решение:
Смесь, состоящая из двух объёмов водорода и одного объёма кислорода, называется гремучей смесью. При поджигании этой смеси происходит сильный взрыв. В обычных условиях водород с кислородом не взаимодействует. Малая скорость этой реакции при обычных условиях обусловлена высокой энергией активации данной реакции. И, если бы данная реакция при н. у. находилась в состоянии равновесия, то при внесении катализатора равновесие процесса не сместится. Объяснить это можно тем, что катализаторы – это вещества, которые увеличивают скорость протекания реакций как прямой, так и обратной, что, само собой на смещение равновесия не влияет. Так как в данной системе при внесении катализатора начинает протекать реакция, то можно сделать вывод: система не находится в состоянии равновесия.
В действительности данная реакция относится к реакциям цепного характера, не к обратимым реакциям. Обычно цепные реакции протекают с участием активных центров - атомов водорода, кислорода и гидроксид-радикалов.
Применение катализатора сильно увеличивает скорость взаимодействия между молекулами Н2 и О2, что приводит к образованию двух гидроксильных радикалов:
H2 + O2 = OH. + OH.
Затем радикалы ОН. реагируют с молекулой Н2:
ОН. + H2 = H2O + H.
далее
H. + O2 = O. + OH.
Затем могут протекать следующие процессы:
H. + OH. = H2O;
2H. + O. = H2O.
Процесс ускоряется – реакция протекает со взрывом.
Задача 807.
Исходя из указанных значений электродных потенциалов:
H2 + 2 = 2Н-,
= 2Н-,  0 = 2,23B;
0 = 2,23B;
2H+ + 2 = H2,
= H2,  0 = 0,41B (при pH = 7).
0 = 0,41B (при pH = 7).
установить, может ли гидрид-ион существовать в водных растворах: а) да; б) нет?
Решение:
Сначала установим, может ли самопроизвольно протекать данная реакция, по величинам стандартных потенциалов водородных электродов. Из законов электрохимии вытекает, что окислителем всегда служит электрохимическая система с более высоким значением потенциала. Поскольку потенциал Н+ значительно больше, чем потенциал Н-, то практически при любых концентрациях ионов Н+ и Н– будут реагировать друг с другом с образованием Н2, при этом гидрид-ион будет служить восстановителем и окисляться ионом Н+. Реакция будет протекать слева направо:
H+ + H- ⇔ H2.
В водном растворе всегда присутствуют ионы Н+, образуемые при диссоциации воды:
H2O ⇔ H+ + OH-.
Таким образом, гидрид-ион Н- не может существовать в водном растворе, потому что он взаимодействует с ионом водорода по ионно-молекулярному уравнению:
H+ + H-⇔ H2.
Ответ: б).

