Химизм зарядки и разрядки аккумулятора. Концентрация ионов на электродах
Решение задач по химии на составление схемы аккумулятора
Задание 256.
Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (+2) (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn2+] = 0,00 1 моль/л? Ответ: 7,3 моль/л.
Решение:
Цинк имеет меньший потенциал (-0,763 В) и является анодом, на котором протекает окислительный процесс:
Zn0 - 2 = Zn2+ (1)
= Zn2+ (1)
Железо, потенциал которого (-0,440 В) - катод, т.е. электрод, на котором протекает восстановительный процесс:
Fe2+ + 2 = Fe0 (2)
= Fe0 (2)
Схема гальванического элемента имеет вид:
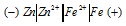
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
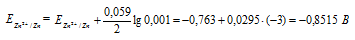
ЭДС гальванического элемента равна нулю, если электродные потенциалы электродов равны, следовательно, электродный потенциал железа численно равен электродному потенциалу цинка, т.е. равен -0,8515 В. Рассчитаем концентрацию ионов железа Fe2+, если электродный потенциал железного электрода равен -0,8515 В, получим:
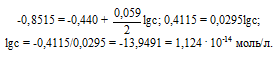
Ответ: сFe2+ = 1,124 . 10-14 моль/л.
Задание 257.
Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению: Ni + Pb(NO3)2 = Ni(NO3)2 + Рb. Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Pb2+] = 0,0001 моль/л, [Ni] = 0,01 моль/л. Ответ: 0,064 В.
Решение:
Уравнение реакции имеет вид:
Ni + Pb(NO3)2 = Ni(NO3)2 + Рb
Из уравнения реакции вытекает, что никель является анодом, на котором протекает окислительный процесс:
Ni0 - 2 = Ni2+ (1)
= Ni2+ (1)
Свинец – катод, электрод на котором протекает восстановительный процесс:
Pb2+ + 2 = Pb0 (2)
= Pb0 (2)
Схема гальванического элемента будет имеет вид:
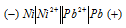
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
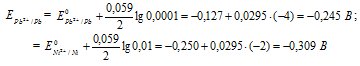
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
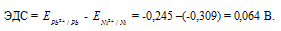
Ответ: 0,064 В.
Задание 258.
Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
Решение:
В свинцовом аккумуляторе в качестве электролита используется раствор H2SO4 (p = 1,24-130 г/см3). Электроды этого аккумулятора представляют свинцовые решётки. Решётки сначала заполняются оксидом свинца (IV) PbO2, который при взаимодействии с H2SO4 превращается в PbSO4. Сначала аккумулятор нужно зарядить. Суммарная реакция зарядки в аккумуляторе имеет вид:
2PbSO4 + 2H2O ⇔ Pb + PbO2 + 2H2SO4 (молекулярная форма);
2PbSO4 + 2H2O ⇔ Pb + PbO2 + 4H+ + 2SO42- (ионно-молекулярная форма)
Электрохимические процессы при зарядке:
Анод: PbSO4 + 2H2O - 2 = PbO2 + 4H+ + SO42-
= PbO2 + 4H+ + SO42-
Катод: PbSO4 + 2 = Pb2+ + SO42-
= Pb2+ + SO42-
При разрядке свинцового аккумулятора протекает следующая химическая реакция:
Pb + PbO2 + 2H2SO4 ⇔ 2PbSO4 + 2H2O (молекулярная форма);
Pb + PbO2 + 4Н+ + SO42- ⇔ 2PbSO4 + 2H2O ионно-молекулярная форма)
Электрохимические процессы при разрядке аккумулятора:
Анод: Pb2+ + SO42- - 2 ⇔ PbSO4;
⇔ PbSO4;
Катод: PbO2 + 4H+ + SO42- + 2 ⇔ PbSO4 + 2H2O
⇔ PbSO4 + 2H2O
При разрядке аккумулятора:
К(+): PbO2 + 4H+ + 2 → Pb2+ + 2H2O;
→ Pb2+ + 2H2O;
А(-): Pb0 → Pb2+ + 2
Суммарная реакция:
PbO2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O
При зарядке аккумулятора:
К(+): Pb2+ + 2 → Pb0
→ Pb0
А(-): Pb2+ + 2H2O → PbO2+4H++ 2
Суммарная реакция:
2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4
Задание 259.
Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
Решение:
При зарядке аккумулятора:
А(+): Ni(OH)2 + OH- → NiOOH + H2O + 1
К(-): Cd(OH)2 + 2 → Cd + 2OH-
→ Cd + 2OH-
Суммарная реакция:
2Ni(OH)2 + Cd(OH)2 → 2NiOOH + Cd + 2H2O
При разрядке аккумулятора:
К(+): NiOOH + H2O + 1 - → Ni(OH)2 + OH-
- → Ni(OH)2 + OH-
А(-): Cd + 2OH- → Cd(OH)2 + 2 -
-
Суммарная реакция:
2NiOOH + Cd + 2H2O → 2Ni(OH)2 + Cd(OH)2
Задание 260.
Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
Решение:
При зарядке аккумулятора:
А: Ni2+ → Ni3+ + 1
К: Fe2+ + 2 → Fe0
→ Fe0
Суммарная реакция:
2Ni(OH)2 + Fe(OH)2 → NiOOH + Fe + 2H2O
При разрядке аккумулятора:
А: Fe0 → Fe2+ + 2
К: Ni3+ + 1 → Ni2+
→ Ni2+
Суммарная реакция:
NiOOH + Fe + 2H2O → 2Ni(OH)2 + Fe(OH)2

