Окисление-восстановление водорода на электродах гальванического элемента
Задача 662.
Гальванический элемент состоит из стандартного водородного электрода и водородного электрода, погруженного в раствор с рН = 12. На каком электроде водород будет окисляться при работе элемента, а на каком - восстанавливаться? Рассчитать э. д. с. элемента.
Решение:
Стандартный электродный потенциал водорода равен нулю. Электродный потенциал водородного электрода, погруженного в раствор с рН =12, вычислим из уравнения:
E = -0,059pH = -0,059 . 12 = -0,71B.
ЭДС гальванического элемента определяется из уравнения:
ЭДС = E(катод) - Е(анод) =
= Е0(2Н+/H2) - E[(2Н+/H2) . (pH = 12)].
Здесь Е0(2Н+/H2) и E[(2Н+/H2) . (pH12)] - потенциалы водородных электродов, отвечающих соответственно стандартному водородному электроду и водородному электроду, погружённому в раствор с рН = 12. Так как значение электродного потенциала водородного электрода, погружённого в раствор с рН = 12 (-0,71 В) более отрицательнее, чем значение потенциала стандартного водородного электрода (0,00В), то он будет являться анодом, а стандартный потенциал – катодом.
Электродные процессы на электродах:
анод: H2О - 2 = 2H+;
= 2H+;
катод: 2H+ + 2 = H2О.
= H2О.
Тогда
ЭДС = -o,71 - (0,00) = -0,71B.
Ответ: -0,71В.
Задача 663.
Э. д. с. гальванического элемента, составленного из двух водородных электродов, равна 272 мВ. Чему равен рН раствора, в который погружен анод, если катод погружен в раствор с рН = 3?
Решение:
Так как катод погружён в раствор с рН = 3, то его электродный потенциал можно рассчитать по уравнению:
E = -o,059pH =
= -o,059 . 3 = 0,177B.
Зная ЭДС гальванического элемента и электродный потенциал катода можно рассчитать электродный потенциал анода, получим:
ЭДС = E(катод) - Е(анод);
Е(анод) - ЭДС = 0,177 - 272 = -0,095B.
Теперь рассчитаем рН раствора, в который погружён анод:
E = -0,059pH = pH =
= E/(-0,059) = 0,095/0,059 = 1,6.
Ответ: 1,6.
Задача 664.
Имеется окислителъно-восстановительная система [Fe(CN)6]2- + 1 = [Fe(CN)6]4-. При каком соотношении концентраций окисленной и восстановленной форм потенциал этой системы будет равен 0,28 В?
= [Fe(CN)6]4-. При каком соотношении концентраций окисленной и восстановленной форм потенциал этой системы будет равен 0,28 В?
Решение:
E(Fe2+/Fe) = o,77.
Электродный потенциал (Е) зависит от концентрации ионов электрода в растворе. Эта зависимость наблюдается и для электрохимических систем и выражается уравнением Нернста:
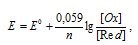
где Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; [Ox] и [Red] - произведения концентраций (активностей) веществ, принимающих участие в соответствующей полуреакции в окисленной ([Ox]) и восстановленной ([Red]) формах. Используя уравнение Нернста, рассчитаем отношение концентраций окисленной и восстановленной форм:
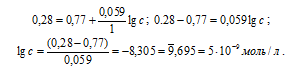
Ответ: 5 . 10-9 моль/л.
Задача 665.
В каких случаях электродный потенциал зависит от рН раствора? Как изменятся при возрастании рН электродные потенциалы следующих электрохимических систем:
а) crO42- + 2H2O + 3 = CrO2- + 4OH-;
= CrO2- + 4OH-;
б) MnO4- + 8H+ + 5 = Mn2+ + 4H2O;
= Mn2+ + 4H2O;
в) Sn4+ + 2 = Sn2+.
= Sn2+.
Ответ обосновать.
Решение:
В тех случаях, когда в электродном процессе участвует вода, электродный потенциал зависит от концентрации ионов Н+ (или ОН-, т.е. от рН раствора.
а) При возрастании рН раствора электродный потенциал электрохимической системы:
СrO42- + 2H2O + 3 = CrO2- + 4OH- будет уменьшаться. Уравнение Нернста для этой системы будет иметь вид:
= CrO2- + 4OH- будет уменьшаться. Уравнение Нернста для этой системы будет иметь вид:
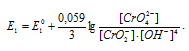
При увеличении рН раствора концентрация ионов становится меньше и тогда численное значение члена 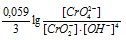 становится меньше, поэтому потенциал системы будет увеличиваться.
становится меньше, поэтому потенциал системы будет увеличиваться.
б) При возрастании рН раствора электродный потенциал электрохимической системы
MnO4- + 8H+ + 5 = Mn2+ + 4H2O будет увеличиваться. Уравнение Нернста для этой системы будет иметь вид:
= Mn2+ + 4H2O будет увеличиваться. Уравнение Нернста для этой системы будет иметь вид:
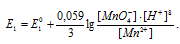
При увеличении рН раствора концентрация ионов [H+] становится меньше и тогда численное значение члена 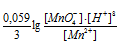 становится больше, поэтому потенциал системы будет уменьшаться.
становится больше, поэтому потенциал системы будет уменьшаться.
в) При увеличении рН раствора электродный потенциал электрохимической системы -
- Sn4+ + 2 = Sn2+ не изменится, так как в электродном процессе не участвует вода.
= Sn2+ не изменится, так как в электродном процессе не участвует вода.
Ответ: а) увеличивается; б) уменьшается; в) не изменяется.

