Как правильно производить расчеты по приготовлению растворов
Задача 435.
Сколько миллилитров концентрированной соляной кислоты (p = 1,19 г/мл), содержащей 38% (масс.) НСI, нужно взять для приготовления 1 л 2н. раствора?
Решение:
M(НСI) = MЭ(НСI) = 36,5 г/моль.
Рассчитаем массу НСI в 1 л 2 н раствора её: 2 . 36,5 = 72,93 г.
Рассчитаем массу 38%-ного раствора по формуле:

где
 - массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
- массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
Тогда
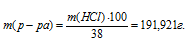
Объём раствора, который необходимо взять для приготовления 1 л 2 н раствора рассчитаем по формуле:
m(p-pa) = p . V,
где
p - плотность, а V – объём раствора, получим:
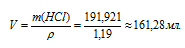
Ответ: 161,28 мл.
Задача 436.
К 100 мл 96%-ной (по массе) H2SO4 (плотность 1,84 г/мл) прибавили 400 мл воды. Получился раствор плотностью 1,220 г/мл. Вычислить его эквивалентную концентрацию и массовую долю H2SO4.
Решение:
Массу раствора 100 мл 96%-ного раствора найдём по формуле:
m(p-pa) = p . V,
где
p - плотность, а V – объём раствора, получим:
m(p-pa) = 1,84 . 100 = 184 г.
Массу серной кислоты в данном растворе находим по формуле:

где
 - массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
- массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
Тогда
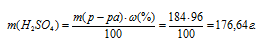
Рассчитаем массу раствора полученного при смешении 100 мл 96%-ного раствора с 400 мл воды, получим:
m'(p-pa) = (100 + 400) . 1,220 = 610 г.
Определим молярную массу эквивалента H2SO4 из соотношения:
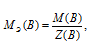
где
MЭ(В) - молярная масса эквивалента кислоты, г/моль; М(В) - молярная масса кислоты; Z(B) - эквивалентное число; Z(кислоты) равно числу ионов Н+, H2SO4 - 2.
Отсюда
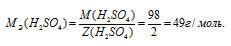
Тогда эквивалентную концентрацию раствора найдём по формуле:
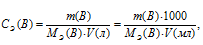
где
m(B)- масса растворённого вещества, MЭ(В) - молярная масса эквивалента растворённого вещества, V – объём раствора (в л или мл).
Отсюда
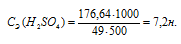
Рассчитаем массовую долю полученного раствора:
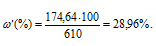
Ответ: 7,2н; 28,96%.
Задача 437.
Рассчитать нормальность концентрированной соляной кислоты (плотность 1,18г/мл), содержащей 36,5% (масс.) НСI.
Решение:
Массу 96%-ного раствора найдём по формуле:
m(p-pa) = p . V,
где
p - плотность, а V – объём раствора, получим:
m(p-pa) = 1,18 . 1000 = 1180 г.
Рассчитаем массу соляной кислоты в растворе по формуле:

где
 - массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
- массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
Тогда
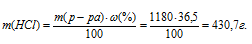
Определим молярную массу эквивалента HCl из соотношения:
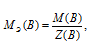
MЭ(В) - молярная масса эквивалента кислоты, г/моль; М(В) - молярная масса кислоты; Z(B) - эквивалентное число; Z(кислоты) равно числу ионов Н+, H2SO4 → 2.
Отсюда
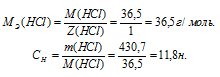
Ответ: 11,8н.
Задача 438.
Какой объем 10%-ной (по массе) серной кислоты (p = 1,07 г/мл) потребуется для нейтрализации раствора, содержащего 16,0 г NaOH?
Решение:
Уравнение реакции нейтрализации раствора NaOH раствором H2SO4 имеет вид:
H2SO4 + 2NaOH ↔ Na2SO4 + 2H2O
Из уравнения реакции следует, что на нейтрализацию 1 моля NaOH затрачивается 0,5 молей NaOH, значит, эквивалентная масса серной кислоты в данной реакции равна 49 г/моль (М/2 = 98/2 = 49).
Теперь рассчитаем массу серной кислоты, необходимую для нейтрализации 16 г NaOH из пропорции:
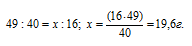
Массу раствора, содержащего 19,6 г H2SO4, рассчитаем по формуле:

где
 - массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
- массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
Тогда
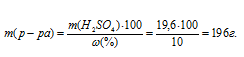
Объём раствора рассчитаем по формуле:
m(p-pa) = p . V,
где - плотность, а V – объём раствора, получим:
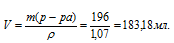
Ответ: 183,18 мл.

