Составление электронных и молекулярных уравнений реакций. Уравнение Нернста (Nernst)
Решение задач по химии на составление электронных и молекулярных уравнений реакций окисления
Задание 241.
В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
Решение:
Стандартные электродные потенциалы цинка, меди и серебра соответственно равны -0,76 В, +0,34 В и +0,80 В. Исходя из того, что цинк имеет более электроотрицательный потенциал, чем медь, то между цинком и медным купоросом проходит реакция (цинк вытесняет медь из соли), и раствор соли при этом обесцвечивается, так как образуется бесцветный сульфат цинка:
Электронные уравнения процесса:
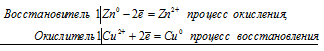
Zn0 + Cu2+ = Zn2+ + Cu0
Молекулярное уравнение процесса:
Zn + CuSO4 = ZnSO4 + Cu
Серебро, имея более электроположительный потенциал, чем медь не способно вытеснять ионы меди из сульфата меди, поэтому раствор медного купороса, с опущенной в него серебряной пластинкой, не обесцвечивается.
Задание 242.
Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) МgSO4; в) Рb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Стандартные электродные потенциалы цинка и меди соответственно равны -0,76 В и +0,34 В. Исходя из того, что цинк имеет более электроотрицательный потенциал, чем медь, то между цинком и медным купоросом проходит реакция (цинк вытесняет медь из соли), и раствор соли при этом обесцвечивается, так как образуется бесцветный сульфат цинка, а цинковая пластинка будет уменьшаться по массе:
Электронные уравнения процесса:
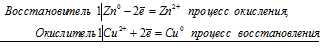
Zn0 + Cu2+ = Zn2+ + Cu0
Молекулярное уравнение процесса:
Zn + CuSO4 = ZnSO4 + Cu
б) Так как стандартный электродный потенциал цинка (-0,76 В) больше, чем стандартный электродный потенциал магния (-2,36 В), то цинк не способен вытеснять магний из растворов его солей, поэтому цинковая пластинка останется без изменений.
в) Так как стандартный электродный потенциал цинка (-0,76 В) меньше, чем у свинца (-0,13 В), то металлический цинк будет обладать большими восстановительными способностями чем ионы Pb2+, и реакция будет протекать с растворением цинковой пластинки, т. е. её масса будет уменьшаться.
Электронные уравнения процесса:
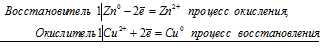
Zn0 + Pb2+ = Zn2+ + Pb0
Молекулярное уравнение процесса:
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
Задание 243.
При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л.
Решение:
Найдём значение электродного потенциала цинка в растворе его соли:
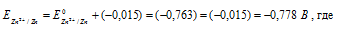
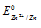 - стандартный электродный потенциал цинка.
- стандартный электродный потенциал цинка.
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов цинка в растворе:
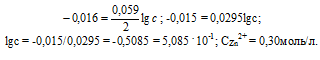
Ответ: 0,30 моль/л.
Задание 244.
Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а); AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Стандартные электродные потенциалы кадмия и серебра соответственно равны -0,403 В и +0,80 В. Исходя из того, что кадмий имеет более электроотрицательный потенциал, чем серебро, то между кадмием и нитратом серебра проходит реакция (кадмий вытесняет серебро из соли), и кадмиевая пластинка при этом будет уменьшаться по массе.
Электронные уравнения процесса:
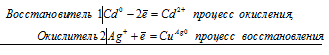
Cd0 + 2Ag+ = Cd2+ + 2Ag0
Молекулярное уравнение процесса:
Cd + 2 АgNO3 = Cd(NO3)2 + 2Ag.
б) Так как стандартный электродный потенциал кадмия (-0,403 В) больше, чем стандартный электродный потенциал цинка (-0,76 В), то кадмий не способен вытеснять цинк из растворов его солей, поэтому кадмиевая пластинка останется без изменений.
в) Так как стандартный электродный потенциал кадмия (-0,403 В) меньше, чем у никеля (-0,25 В), то металлический кадмий будет обладать большими восстановительными способностями чем ионы Ni2+, и реакция будет протекать с растворением кадмиевой пластинки, т. е. её масса будет уменьшаться.
Электронные уравнения процесса:

Cd0 + Ni2+ = Cd2+ + Ni0
Молекулярное уравнение процесса:
Cd + NiSO4 = CdSO4 + N
Задание 245.
Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Мn2+ (моль/л). Ответ: 1,89 . 10-2 моль/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов Mn2+ в растворе:
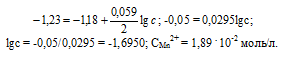
Ответ. 1,89 . 10-2 моль/л.

