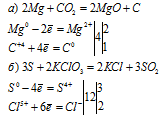"Химия. 9 класс". О.С. Габриелян
Характеристика химических элементов на примере фосфора, калия и магния
Вопрос 1.
а) Характеристика фосфора.
1. Фосфор — (лат. Phosphorus), Р, химический элемент V группы периодической системы Менделеева, атомный номер 15, Z = 15, атомная масса 30,97376. Атом фосфора содержит в ядре 15 протонов, 16 нейтронов и 15 электронов: 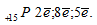
Атомы фосфора проявляют как окислительные свойства (принимают недостающие для завершения внешнего уровня три электрона, проявляя при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами — металлами, водородом и тп.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.).
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2О5. Это кислотный оксид. Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота Н3РО4:
Р2О5 + 3Н2О = 2Н3РО4.
При взаимодействии Р2О5 с основными оксидами и основаниями он дает соли:
Р2О5 + 3CaO = Ca3(PO4)2;
Р2О5 + 6NaOH = 2Na3PO4 + 3Н2О.
6. Высший гидроксид фосфора — фосфорная кислота Н3РО4, проявляет все типичные свойства кислот:
взаимодействие с основаниями и основными оксидами:
Н3РО4 + 3KOH = 2K3PO4 + 3Н2О.
2Н3РО4 + 3CaO = Ca3(PO4)2 + 3Н2О.
7. Фосфор образует летучее соединение Н3Р - фосфин.
б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и Аr(К) = 39. Соответственно заряд ядра его атома +19 равен числу протонов. Следовательно, число нейтронов в ядре равно 20. Число электронов, содержащихся в атоме калия, равно 19.
Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так: 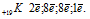
Исходя из строения атома, можно предсказать степень окисления калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1. Восстановительные свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий - простое вещество, для него характерна металлическая кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
З. Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона атома кальция.
5. Оксид калия К2О является основным оксидом и проявляет все типичные свойства основных оксидов, взаимодействие с кислотами и кислотными оксидами:
K2O + 2HJ = 2KJ + Н2О;
K2O + CO2 = K2CO3.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами:
КОН + HJ = KJ + Н2О;
6КОН + P2O5 = 2K3PO4 + 3Н2О.
7. Летучего водородного соединения калий не образует, а образует гидрид калия KH.
Вопрос 2.
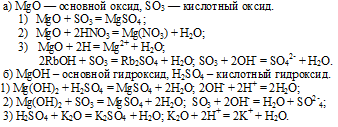
Вопрос 3.
Магний — простое вещество, для него характерна металлическая кристаллическая решетка; он обладает металлическим блеском, электропроводностью.
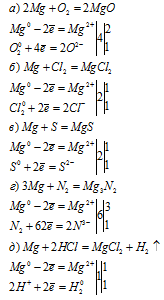
Аллотропия химических элементов
Вопрос 4.
Аллотропия — явление существования химического элемента в виде нескольких простых веществ, различных по строению и свойствам (так называемых аллотропных форм).
а) В молекулах состава S2 реализуется ковалентно-неполярный тип связи (т.е. не происходит смещения электронной пары, образующей связь).
б) В молекулах состава Н2S реализуется ковалентно-полярный тип связи, т.к. происходит смещение электронной пары к более электроотрицательному атому — сере (S):
Н → S ← Н
Физические свойства ромбической серы (S2):
вещество лимонно-желтого цвета, устойчивое до t = 95,6 °С, растворяется в сероуглероде (CS2), анилине, бензоле, феноле.
Уравнения реакций:
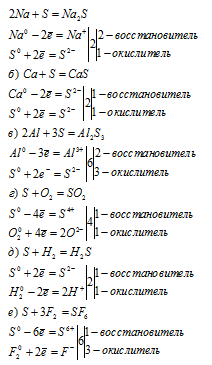
Вопрос 5.
Неметаллические свойства кремния выражены слабее, чем у фосфора, но сильнее, чем у алюминия.
Вопрос 6.
а) У азота кислотные свойства выражены сильнее, чем у фосфора, т.к. в группах сверху вниз происходит усиление основных и ослабление кислотных свойств.
б) У серы кислотные свойства выражены сильнее, чем у фосфора, так как в периодах слева направо происходит усиление кислотных и ослабление основных свойств.
Вопрос 7.

Вопрос 8.
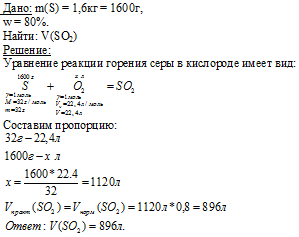
Вопрос 9.
Нет, нельзя. Прежде всего, из-за различия в степенях окисления. В оксиде сера имеет степень окисления 6+. В сернистой кислоте — 4+. Высшему оксиду SO3 соответствует серная кислота H2SO4. Сернистой кислоте H2SO3 соответствует оксид SO2.
Данные соответствия можно показать гидролизом оксидов:
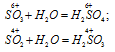
Вопрос 10.