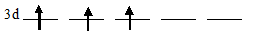Составление электронных формул атомов элементов
Задание 27.
Какие орбитали атома заполняются электронами раньше 4d или 5s; 6s или 5р? Почему? Напишите электронную формулу атома элемента с порядковым номером 43.
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали (АО) могут находиться не более двух электронов, различающихся своими спинами ms = 1/2. Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО. Исходя из этого, на s-подуровне максимальное число электронов может быть равно двум [2 (2 . 0 + 1) = 2], на р-подуровне – трём [2 (2 . 1 + 1) = 6], на d-подуровне - [2 (2 . 2 + 1) = 10], на f-подуровне - [2 (2 . 3 + 1) = 14]. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→
→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→6d→7p.
Так как на 4d-подуровне сумма n + l равна 6 (4 + 2 = 6), на 5s-подуровне - 5 (5 + 0 = 5), то сначала будет заполняться 5s-подуровень, где сумма чисел n + l наименьшая. На 6s-подуровне сумма n + l равна 6 (6 + 0 = 6), на 5р-подуровне - 6 (5 + 1 = 6), то, согласно правилу Клечковского, сначала будет заполняться 5р-подуровень, где главное квантовое число имеет меньшее значение (второе правило Клечковского).
Так как число электронов в атоме элемента равна его порядковому номеру в периодической системе химических элементов таблицы Д. И. Менделеева, то для элемента 43 (технеция) электронная формула будут иметь вид:
+43Тс 1s22s22p63s23p63d104s24p64d55s2.
Задание 30.
Напишите электронные формулы атомов элементов с порядковыми но-мерами 14 и 40. Сколько свободных 3d-орбиталей у атомов последнего элемента?
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали (АО) могут находиться не более двух электронов, различающихся своими спинами ms = 1/2. Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО. Исходя из этого, на s-подуровне максимальное число электронов может быть равно двум [2 (2 . 0 + 1) = 2], на р-подуровне – трём [2 (2 . 1 + 1) = 6], на d-подуровне - [2 (2 . 2 + 1) = 10], на f-подуровне - [2 (2 . 3 + 1) = 14]. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→
→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→6d→7p.
Так как число электронов в атоме элемента равна его порядковому номеру в периодической системе химических элементов таблицы Д. И. Менделеева, то для элементов 14 (кремния) и 40 (циркония) электронные формулы будут иметь вид:
+14Si 1s22s22p63s23p2;
+40Zr 1s22s22p63s23p63d104s24p64d25s2.
Цирконий на 4d-подуровне содержит два электрона каждый из которых занимает по одной АО (правило Хунда), то свободными остаются три 4d-орбитали:
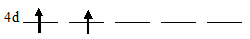
Задание 32.
Напишите электронные формулы атомов элементов с порядковыми но-мерами 15 и 28. Чему равен максимальный спин р-электронов у атомов первого и d-электронов у атомов второго элемента?
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали (АО) могут находиться не более двух электронов, различающихся своими спинами ms = 1/2. Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО. Исходя из этого, на s-подуровне максимальное число электронов может быть равно двум [2 (2 . 0 + 1) = 2], на р-подуровне – трём [2 (2 . 1 + 1) = 6], на d-подуровне - [2 (2 . 2 + 1) = 10], на f-подуровне - [2 (2 . 3 + 1) = 14]. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→
→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→6d→7p.
Так как число электронов в атоме элемента равна его порядковому номеру в периодической системе химических элементов таблицы Д. И. Менделеева, то для элементов 15 (фосфора) и 28 (никеля) электронные формулы будут иметь вид:
+15Р 1s22s22p63s23p3;
+28Ni 1s22s22p63s23p63d84s2.
Спин электрона возникает за счёт вращения его вокруг собственной оси. У атома фосфора на внешнем энергетическом уровне на 3р-подуровне находятся три неспаренных электрона, на каждой р-орбитали по одному, поэтому максимальный спин р-электронов будет равен сумме спинов каждого из трёх электронов: (+1/2) + (+1/2) + (+1/2) = +1,5. Графическая схема 3р-подуровня:
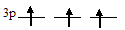
Максимальный спин d-электронов у атома никеля равен +1, так как у атома никеля на 3d-подуровне имеется шесть спаренных и два неспаренных электрона, которые имеют спи-ны +1/2, что в сумме даёт +1 [(+1/2) + (+1/2) = +1] (принцип Паули).
Задание 33.
Напишите электронные формулы атомов элементов с порядковыми но-мерами 21 и 23. Сколько свободных 3d-орбиталей в атомах этих элементов?
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали (АО) могут находиться не более двух электронов, различающихся своими спинами ms = 1/2. Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО. Исходя из этого, на s-подуровне максимальное число электронов может быть равно двум [2 (2 . 0 + 1) = 2], на р-подуровне – трём [2 (2 . 1 + 1) = 6], на d-подуровне - [2 (2 . 2 + 1) = 10], на f-подуровне - [2 (2 . 3 + 1) = 14]. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→
→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→6d→7p.
Так как число электронов в атоме элемента равна его порядковому номеру в периодической системе химических элементов таблицы Д. И. Менделеева, то для элементов 21 (скандий) и 23 (ванадий) электронные формулы будут иметь вид:
+21Sс 1s22s22p63s23p63d14s2;
+23V 1s22s22p63s23p63d34s2.
Скандий на 3d-подуровне содержит один электрон, который занимает одну АО (правило Хунда), то свободными остаются четыре 3d-орбитали:
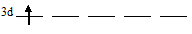
Ванадий на 3d-подуровне содержит три электрона каждый из которых занимает по одной АО (правило Хунда), то свободными остаются две 3d-орбитали: