"Химия. 11 класс". О.С. Габриелян
Теории строения атома
Вопрос 1.
То, что атом — сложная частица, доказывают явления  - и
- и 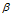 - излучений, а также явление фотоэффекта.
- излучений, а также явление фотоэффекта.
Вопрос 2.
Классическая теория строения атома развивалась следующим образом:
1. Гипотеза Дж. Томпсона. Модель атома — «сливовый пудинг», т.е. атом — представляет собой каплю пудинга, внутри которой хаотично находятся «сливины» — электроны, которые совершают колебательные движения. Эта модель не подтверждалась экспериментальными данными.
2. Планетарная модель атома Э Резерфорда, которая предполагает, что атом состоит из положительно заряженного ядра и электронов, которые вращаются вокруг него по замкнутым орбитам, как планеты солнечной системы обращаются вокруг солнца.
Эта модель не объясняла излучение и поглощение энергии атомом.
3. Н. Бор внес в планетарную модель атома квантовые представления:
а) Электрон вращается вокруг ядра по строго определенным замкнутым стационарным орбитам в соответствии с «разрешенными» значениями энергии Е1, Е2 ... Еn, при этом энергия не выделяется и не поглощается.
б) Электрон переходит из одного «разрешенного» энергетического состояния в другое, что сопровождается излучением или поглощением кванта света.
Теория была построена на противоречиях.
4. Протонно-нейтронная теория рассматривает атом как частицу, состоящую из ядра с находящимися внутри него протонами и нейтронами, и обращающихся вокруг ядра электронов. Электроны, протоны и нейтроны – элементарные частицы, которые имеют чрезвычайно малые массы и геометрические размеры. Нейтроны не имеют заряда, а протоны и электроны – заряжённые частицы. Причем принято, что протон несёт положительный, а электрон – отрицательный заряды.
Вопрос 3.
Частицы микромира имеют корпускулярные свойства, например, обладают массой, но также для них характерны такие волновые свойства, как дифракция и интерференция.
Вопрос 4.
Все объекты макромира имеют корпускулярную природу, т.е. являются только частицами, а объекты микромира имеют корпускулярную природу (обладают массой и геометрическими размерами) и, одновременно, проявляют волновые свойства (дифракция и интерференция). Местонахождение и движение микрочастиц можно определить с любой точностью, а местонахождение и движение микрочастиц невозможно определить с большой точностью, т.е. координата и скорость всегда имеют погрешности определения, они как бы размыты. Таким образом, движение микрочастиц нельзя характеризовать траекторией как точной линией (принцип неопределённости Гейзенберга). Например, движение электрона в атоме нельзя рассматривать как движение точечного заряда по строго определённой замкнутой траектории – орбите.
Вопрос 5.
Физики доказали экспериментально, что электрон - делимая частица, но для химиков это открытие не несет особой важности, так как почти все свойства веществ объясняются строением электронной оболочки атома, поэтому для химиков электрон остается элементарной частицей.

