Химия. 11 класс". О.С. Габриелян
Электронное строение атома
Вопрос 1.
Движение электрона в атоме нельзя рассматривать как движение точечного заряда по строго определённой замкнутой траектории (принцип неопределённости Гейзенберга), можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра, он может находиться в любой части этого пространства.
Вопрос 2.
Орбиталь – это пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, совокупность различных положений электрона в этом пространстве называется электронным облаком.
Вопрос 3.
При электролизе можно узнать количество пропущенного заряда g = It, который численно будет равен заряду, разряжённому на электроде.
Q = N . f .  , где
, где
N – число частиц, f – условный заряд частицы,  - элементарный заряд.
- элементарный заряд.
N = n . NA, где
n – количество вещества, разряжённого на электроде;
NA - число Авогадро.
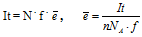
Вопрос 4.
Радиус 2s-орбитали больше радиуса 1s-орбитали, а также энергия электронов, находящихся на 2s-орбитали больше энергии электронов, находящихся на 1s-орбитали.
Вопрос 5.
Главное квантовое число (n) – натуральное число, обозначающее номер энергетического уровня и характеризующее энергию электронов, занимающих данный энергетический уровень. Численно главное квантовое число электрона на внешнем уровне равно номеру периода в системе Д. Менделеева, к которому принадлежит данный химический элемент.
Вопрос 6.
Электроны, обладающие одинаковой энергией, образуют подуровень. Энергии электронов различных подуровней имеют разные численные значения. Число подуровней на внешнем энергетическом уровне равно номеру периода.

