Атомные орбитали. Изменение значений первых потенциалов ионизации у элементов
Задача 201.
Каков физический смысл обычно изображаемых атомных орбиталей (s-, p- орбиталей):
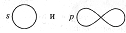
а) поверхность равной электронной плотности, внутри которой заключена произвольная часть электронного облака; б) траектория движения электрона; в) поверхность, внутри которой заключено электронное облако; г) поверхность равной электронной плотности, внутри которой заключена определенная часть электронного облака?
Решение:
Орбитальное квантовое число l определяет момент количества движения электрона и характеризует пространственную форму электронного облака. Электроны, характеризующиеся значениями орбитального квантового числа l = 0 и l = 1, называют, соответственно s- и p-электронами. Электронное облако не имеет резко очерчённых в пространстве границ. Установлено, что волновая функция s-электрона имеет шаровую форму, шаровую симметрию и изображается графически так:
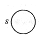
Волновая функция p-электронов характеризуется гантелевидной конфигурацией и изображается графически так:

Орбитальное квантовое число l характеризует определённые энергетические состояния электронов на данном подуровне, определяет форму электронного облака, а также орбитальный момент (p -момент) импульса электрона при его вращении вокруг ядра.
Графические изображения s-, p- и других электронов обозначают поверхность равной электрической плотности, внутри которой заключена определённая часть электронного облака. Принято очерчивать границу электронного облака, внутри которого находится 90% его электронной плотности, т.е. вероятность нахождения электрона в атоме.
Ответ: г).
Задача 202.
Как зависит энергия электрона в многоэлектронном атоме от орбитального квантового числа при постоянном значении главного квантового числа: а) увеличивается с ростом l; б) уменьшается с ростом l; в) остается неизменной?
Потому что: 1) размеры электронного облака определяются только значением главного квантового числа (n); 2) при одном и том же n электроны с большим значением l сильнее экранируются внутренними электронами; 3) с увеличением l степень вырождения подуровня растет.
Решение:
В многоэлектронных атомах происходит расщепление энергетических уровней на подуровни, т.е. оказывается, что электроны при одинаковом значении n, но разном l несколько различаются значениями полной энергии Enl. Расщепление энергетических уровней в многоэлектронных атомах можно объясняется тем, что энергия каждого электрона определяется не только взаимодействием электрона с ядром, но и взаимодействием с другими электронами. В таких атомах полная энергия электрона задаётся не только главным квантовым числом n, но и орбитальным l, которые определяет как число орбиталей, так и их взаимное расположение на данном энергетическом уровне. Это объясняется тем, что электрон в атоме не только притягивается ядром, но и испытывает отталкивание со стороны электронов, расположенных между данным электроном и ядром. Внутренние электронные слои как бы образуют своеобразный экран, ослабляющий притяжение электрона к ядру или как принято говорить, экранируют внешний электрон от ядерного заряда. При этом экранирование для электронов, различающихся между собой значением l, неодинаково. Установлено, что с увеличением значения орбитального квантового числа l при одном и том же значении главного квантового числа n экранирование электрона увеличивается, что приводит к более высокому состоянию энергии электрона.
Ответ: а) 2.
Задача 203.
Как изменяются значения первых потенциалов ионизации в ряду элементов Li, Bе, В, С, N, О, P, Nе: а) увеличиваются; б) уменьшаются; в) изменяются нерегулярно, но имеют тенденцию к возрастанию?
Решение:
В пределах периода с увеличением порядкового номера элемента (Z) имеет место тенденция к уменьшению размеров атомов. Это объясняется увеличивающимся притяжением электронов внешнего слоя к ядру по мере возрастания его заряда. Закономерно с уменьшением радиуса атомов (ra) в периоде возрастает потенциал ионизации (I1) атомов элементов второго периода. Но изменение потенциала ионизации в ряду элементов Li, Bе, В, С, N, О, P, Nе происходит нерегулярно. Так у Li потенциал ионизации наименьший (5,39), так как радиус его атома имеет наибольшее значение, чем у остальных элементов 2-го периода. Один 2s1-электрон Li легко отрывается от атома ещё и потому что 1s-электронное облако экранирует ядро и снижает эффективный заряд (Zэф).
При переходе к Be эффект экранирования остаётся тем же, но радиус атома становится меньше, чем у Li, что, несомненно, ведёт к увеличению потенциала ионизации I1. Однако у атома бериллия завершается заполнение электронами 2s-подуровня, что приводит к более устойчивому состоянию атома и, потенциал ионизации I1 повышается.
У атома бора появляется новый p-подуровень, что приводит к снижению энергии для отрыва единственного 2p-электрона. Таким образом, у атома бора, не смотря на возрастание заряда, отрыв 2p-электрона требует меньшей затраты энергии, чем отрыв 2s-электрона от атома бериллия. Далее у атомов углерода и азота, по мере заполнения 2p-орбиталей по одному электрону происходит рост потенциала ионизации I1.
У атома кислорода начинается заполнение 2p-орбиталей вторыми электронами, что приводит к формированию менее устойчивой системы, чем у атома азота с полностью заполненными 2p-орбиталями по одному электрону. Поэтому для отрыва 2p-электрона у атома кислорода затрачивается меньше, чем у атома азота, и потенциал ионизации I1 понижается. Далее у атомов фтора и неона происходит заполнение оставшихся 2p-орбиталей вторыми электронами, что повышает энергию отрыва внешнего электрона от атома и, соответственно, происходит повышение энергии ионизации атомов фтора и неона. Наиболее устойчивой системой является полностью заполненный электронами 2p-подуровень. Поэтому наибольшее значение I1 будет у атома Ne (21,56).
Таким образом, у элементов 2-го периода значения первых потенциалов ионизации (I1) изменяются нерегулярно, но имеют тенденцию к повышению.
Ответ: в).
Задача 204.
У какого из атомов первый потенциал ионизации выше у бериллия или у бора: а) у Ве; б) у В?
Потому что: 1) при переходе от Ве к В возрастает заряд ядра; 2) электронные конфигурации с полностью заполненным подуровнем обладают повышенной устойчивостью; 3) при переходе от Ве к В уменьшается размер атома.
Решение:
Бериллий и бор являются элементами 2-го периода периодической системы химических элементов Д. И. Менделеева. В пределах одного периода с увеличением порядкового номера элементов (Z) имеет место тенденция к уменьшению размеров атомов. Это объясняется увеличением притяжения электронов к ядру по мере возрастания его заряда. В связи с уменьшением размеров атомов в периоде слева направо наблюдается тенденция к возрастанию потенциала ионизации I1. Однако у бериллия I1 равен 9,3В. Что несколько превышает значение такового у бора – 8,3В. Объясняется это тем, что у бериллия заканчивается заполнение электронами 2s-подуровня, что повышает затраченную энергию на ионизацию. Кроме того, к повышению I1 атома бериллия ведёт и уменьшение радиуса его атома.
У атома бора появляется новый 2p-подуровень с одним электроном, что, не смотря на повышение заряда ядра его атома, ведёт к понижению энергии, необходимой для отрыва 2p1-электрона, чем для отрыва 2s2-электрона от атома бериллия.
Таким образом, на потенциал ионизации I1 влияет не только Z атома и его размеры, но и электронная конфигурация атома, а также то полностью или не полностью заполнены электронами атомные орбитали энергетического подуровня.
Ответ: а2.
Задача 205.
Какая из приведенных электронных конфигураций нормального состояния атома является правильной:

Потому что: 1) в случаях ... нарушено правило Хунда; 2) в случаях ... нарушен принцип Паули; 3) в случаях ... энергия атома не минимальна.
Решение:

При заполнении данной электронной конфигурации нарушено правило Хунда, согласно которому минимальной энергии атома соответствует такое распределение электронов по атомным орбиталям (АО) данного p-подуровня, при котором абсолютное значение суммарного спина атома максимально; при любом другом размещении электронов атом будет находиться в возбуждённом состоянии, т.е. будет характеризоваться более высокой энергией. Орбитали p-подуровня должны заполняться сначала по одному электрону с одинаковыми спинами (+1/2), а затем по второму электрону с противоположными спинами (-1/2). В данной конфигурации энергия атома не минимальна, потому что при наличии четырёх электронов на p-подуровне абсолютное значение суммарного спина должно быть равно (1), а при таком размещении электронов – равно (0), т.е. нарушено правило Хунда.
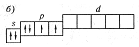
Размещение электронов на s- и p-подуровнях на этой графической схеме показано правильно в соответствии с правилом Хунда, суммарный спин атома имеет максимальное значение (1).
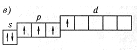
Согласно правилу Хунда четыре электрона на p-подуровне размещаются таким образом, что абсолютное значение суммарного спина должно быть равно(1). Правильной схемой является схема, в которой на p-подуровне в первой АО расположено два электрона с противоположными спинами (+1/2, -1/2), а в двух остальных АО - по одному электрону с положительным значением спинов. В данной схеме показано, что один из p-электронов получил дополнительную энергию и был переведён на d-подуровень, т.е. атом перешёл в возбуждённое состояние, энергия не минимальна.

В схеме г) нарушен принцип Паули, согласно которому в атоме не может быть двух электронов с одинаковым набором квантовых чисел. Из этого принципа следует, что каждая АО может быть занята не более чем двумя электронами, причём их спины должны быть различными, что символически изображают так: 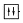 . На данной же схеме показано, что в p-орбитали находятся два электрона с одинаковыми спинами (+1/2).
. На данной же схеме показано, что в p-орбитали находятся два электрона с одинаковыми спинами (+1/2).
Ответ: б) так как; а)1 и 3; в)3; г)2.

