Характерные типы гибридизации атомных орбиталей (АО) для углерода
Метод валентных связей (ВС)
Задача 944.
Какие типы гибридизации АО характерны для углерода? Описать с позиций метода ВС строение молекул СН4, С2Н6, С2Н4 и С2Н2.
Решение:
Для углерода характерны sp3-, sp2-, sp-гибридизации АО.
а) В СН4 атом углерода находится в состоянии sp3-гибридизации. Атом углерода в молекуле СН4 содержит четыре sp3-гибридные орбитали, образующиеся в результате линейной комбинации одной s-орбитали и трёх р-орбиталей. Четыре sp3-орбитали располагаются друг относительно друга под углом 109,5 0. Они направлены к вершинам тетраэдра, в центре которого находится ядро атома углерода (рис. 1.). Все четыре sp3-гибридные орбитали равноценны.
Понятие sp3-гибридизации позволяет объяснить факт четырёхвалентности атома углерода и то, что все четыре связи С—Н в молекуле метана равноценны.
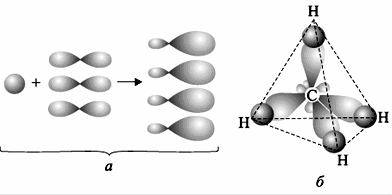
Рис. 1. Схемы образования четырех гибридных орбиталей при sp3-гибридизации (а) и молекулы метана (б) (Материал взят с сайта him.1september.ru).
б) В молекуле С2Н6 атомы углерода находятся в состоянии sp3-гибридизации. Каждый атом углерода соединён с тремя атомами водорода и друг с другом. Вокруг одинарной углерод-углеродной (С—С) связью возможно практически свободное вращение атомов. При этом метильные группы (—СН3) могут ориентироваться относительно друг друга различным образом. Состояние молекулы с определённым взаимным расположением атомов называется конформацией. При вращении одной метильной группы в этане относительно другой на 3600 молекула трижды принимает каждую из приведённых форм А и В. В форме В атомы водорода находятся на минимальном расстоянии друг от друга и максимально взаимодействуют (заслонённая форма). Энергетически выгодной является форма, когда одна метильная группа повёрнута относительно другой на 600 (заторможенная форма). Конформационные формы – это разные формы молекул одного и того же вещества.
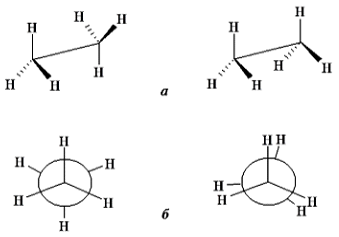
Рис. 2. Формулы Ньюмена для этана. Перспективные формулы (а) и проекции Ньюмена
(б) для заторможенной и заслоненной конформации этана (Информация взята с сайта биржи Автор24: author24.ru)
в) В молекуле С2Н4 между атомами углерода имеется двойная связь. Атомы углерода, между которыми имеется двойная связь, находятся в состоянии sр2-гибридизации. Это означает, что в гибридизации АО участвует одна s- и две р-орбитали, а оставшаяся третья р-орбиталь остаётся негибридизированной. Перекрывание гибридных орбиталей приводит к образованию σ -связей, а за счёт негибридизированных р-орбиталей двух атомов углерода образуется вторая связь π -связь. Таким образом, двойная связь состоит из одной σ -связи и одной π -связи. Гибридные орбитали атомов, образующих двойную связь (σ -связь), находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Три σ-связи, которые участвуют в образовании связей между атомами углерода и водорода, располагаются под углом в 1200 друг к другу (рис. 3.).
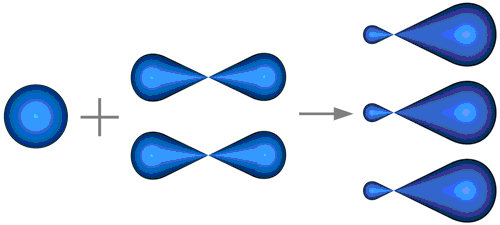
Рис. 3. Образование sp2-гибридных орбиталей (По материалам сайта: physic.kemsu.ru).

Рис. 4. Модель атома с sp2-гибридными орбиталями (По материалам сайта http://physic.kemsu.ru).
г) В молекуле С2Н2 имеется тройная связь, Атомы углерода, между которыми имеется тройная связь, находятся в состоянии sp-гибридизации.Это означает, что в гибридизации участвует одна s- и одна р-орбиталь, а две р-орбитали соседних атомов углерода образуют две π -связи. Два гибридных sp-облака в результате взаимного отталкивания располагаются относительно ядра атома таким образом, что угол между ними составляет 1800. Таким образом, тройная связь между двумя атомами углерода в молекуле ацетилена, состоит из одной σ -связи и двух π-связей. Каждый атом углерода в молекуле С2Н2 образует две σ-связи – одну с атомом водорода, другую – с соседним атомом углерода, что придаёт молекуле линейную форму (рис. 5.).
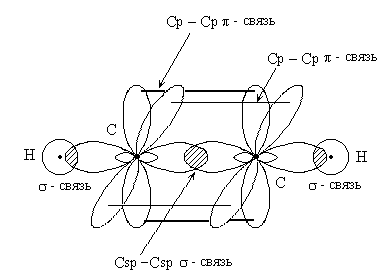
Рис. 5. Образование молекулы ацетилена С2Н2
Таким образом, в возбуждённом состоянии атом углерода имеет четыре неспаренных электрона, которые в зависимости от того в какой фрагмент молекулы органического соединения входит данный атом углерода, вступают в ту или иную гибридизацию АО.
Задача 945.
Охарактеризовать физические и химические свойства диоксида углерода и области его практического применения. Написать уравнения реакций взаимодействия СО2 с раствором щелочи при недостатке и при избытке СО2.
Решение:
а) При обычных условиях диоксид углерода бесцветный газ со слабым кисловатым запахом и вкусом. При 20 0С и давлении 5,7 МПа он сжижается, Испарение жидкого СО2 приводит к охлаждению и образованию твёрдого СО2, известного под названием «сухой лёд». При -78 0С твёрдый СО2 сублимируется (испаряется без плавления). В 1 л воды при 20 0С растворяется 0,9 л СО2.
СО2 – кислотный оксид. Он взаимодействует с основными оксидами и сильными основаниями:
СО2 + СаО ↔ СаСО3;
СО2 + Са(ОН)2 ↔ СаСО3 + Н2О.
Однако кислотообразующие свойства СО2 выражены слабо.
СО2 + Н2О ↔ Н2СО3
Равновесие сильно смещено влево, Только одна молекула СО2 из шестисот превращается в угольную кислоту. Диоксид углерода – слабый окислитель. Углерод в молекуле СО2 проявляет наибольшую степень окисления +4. Вследствие этого СО2 проявляет окислительные свойства, но является слабым окислителем:
СО2 +2Mg = 2MgO + C;
CO2 + C  2CO.
2CO.
б) Уравнения реакций СО2 с NaOH:
a) CO2 (недостаток) + 2NaOH = Na2CO3 + H2O;
a) CO2 (избыток) + NaOH = NaНCO3.

