Константа нестойкости комплексного иона. Общая энергия системы
Решение задач по химии на расчёт общей энергии системы комплексного иона
Задание 313.
Константы нестойкости комплексных ионов [Сo(CN)4]2-, [Hg(CN)4]2-, [Cd(CN)4]2-, соответственно равны 8 . 10-20; 4 . 10-41; 1,4 . 10-17. В каком растворе, содержащем эти ионы, при равной молярной концентрации ионов СN- больше?
Решение:
Известно, что чем устойчивее комплексный ион, тем меньшее численное значение имеет константа нестойкости данного комплексного иона и наоборот – чем большее численное значение имеет константа нестойкости комплексного иона, тем мене он устойчив. Так как константа нестойкости комплексного иона [Cd(CN)4]2- (1,4.10-17) имеет наибольшее значение, чем ионов [Сo(CN)4]2- (8 . 10-20) и [Hg(CN)4]2- (4 . 10-41), то при равной молярной концентрации ионов CN- больше в растворе [Сo(CN)4]2-.
Задание 315.
При прибавлении раствора КСN к раствору [Zn(NH3)4]SO4 образуется растворимое комплексное соединение К2[Zn(CN)4]. Напишите молекулярное и ионно-молекулярное уравнения реакции. Константа нестойкости какого нона, [Zn(NH3)4]2+ или [Zn(CN)4]2-, больше? Почему?
Решение:
Молекулярное уравнение реакции:
[Zn(NH3)4]SO4 + 4КСN =
= К2[Zn(NH3)4] + 4NH3↑ + K2SO4
Ионно-молекулярное уравнение:
[Zn(NH3)4]2+ + 4СN- =
= [Zn(NH3)4]2- + 4NH3↑
Константа нестойкости иона [Zn(NH3)4]2+ будет больше, чем иона [Zn(CN)4]2-,, так как общая энергия системы [Zn(NH3)4]2+ больше, чем системы [Zn(CN)4]2-. Объясняется это тем, что для данного комплексообразовательного иона Zn2+ значение энергии расщепления ( ) определяется природой лигандов. В спектрохимическом ряду: CN- > NO22- > NH3 > H2O > OH- > F- > Cl- >Br- > I- - слева направо расщепление энергии d-подуровня уменьшается, а энергия взаимного отталкивания двух спаренных электронов увеличивается, т. е. энергия спаривания (Р) у аммиака имеет большее значение, чем у иона CN-.
) определяется природой лигандов. В спектрохимическом ряду: CN- > NO22- > NH3 > H2O > OH- > F- > Cl- >Br- > I- - слева направо расщепление энергии d-подуровня уменьшается, а энергия взаимного отталкивания двух спаренных электронов увеличивается, т. е. энергия спаривания (Р) у аммиака имеет большее значение, чем у иона CN-.
У иона Zn2+ на d-подуровне содержится 10 электронов (конфигурация d10), т. е. все d-электроны спарены, все d-орбитали заселены, и переход электронов с на - подуровень, невозможен. Пространственная структура этого иона – тетраэдр (sр3 – гибридизация)..
В ионе Zn2+ d-орбитали заполняются в соответствии с правилом Хунда, и распределение электронов по dx и dz -орбиталям выразится схемой:
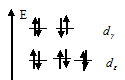
Энергия стабилизации для тетраэдрического поля приближённо определяется соотношением
(0,6 . ndx - 0,4 . ndz)  , где
, где
n – число электронных пар.
Тогда
(0,6 . 2 – 0,4 . 3)  = 0
= 0
С учётом энергии расщепления, энергии стабилизации и энергии спаривания общая энергия системы может быть выражена как Р . n – EСтаб. В нашем случае Е = Р . n - 0, т. е. общая энергия определяется значением энергии спаривания, а она будет больше в случае с NH3, поэтому система [Zn(NH3)4]2+ имеет большее значение энергии стабилизации, т. е. являются менее устойчивой, чем система [Zn(CN)4]2-.

