Тепловой эффект реакции. Вычисление объема газа по термохимическому уравнению
Задача 1.11
Теплота образования оксида железа (III) равна 817 кДж/моль. Определите тепловой эффект реакции, в которой из 16,8 г железа и необходимого количества кислорода образовался Fe2О3.
1) 245,1кДж; 2) 2723кДж; 3) 122,55 кДж; 4) 367,65 кДж.
Дано: теплота образования оксида железа (III) равна: Qобр (Fe2О3) = 817 кДж/моль;
масса потраченного железа: m (Fe) = 16,8 г.
Найти: тепловой эффект.
Решение:
Данный тип задач можно решить двумя способами:
I способ
Согласно определению теплота образования сложного вещества — это тепловой эффект химической реакции образования 1 моль этого сложного вещества из простых веществ.
Записываем реакцию оксида железа (III) из Fe и О2. При расстановке коэффициентов в полученном уравнении учитываем, что перед Fe2О3 должен быть коэффициент «1», который соответствует количеству вещества в 1 моль. В этом случае мы можем использовать теплоту образования, указанную в условии:
2Fe(ТВ) + 3/2О2(г) → Fe2О3(ТВ) + 817 кДж
Получили термохимическое уравнение.
Для того чтобы коэффициент перед Fe2О3 остался равен «1», коэффициент перед кислородом должен быть дробным (3/2).
При записи термохимических уравнений допускаются дробные коэффициенты.
Рассчитываем количество теплоты, которое выделится при образовании Fe2О3 из 16,8 г Fe:
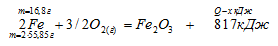
Составляем пропорцию:
при использовании 16,8 г Fe выделяется х кДж (по условию)
при использовании 111,7 г Fe выделяется 817 кДж (по уравнению)
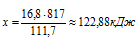
Ближе всего подходит ответ № 3.
При решении последней задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 817 кДж выделяется при использовании 111,7 г Fe. При использовании 16,8 г Fe выделяется х кДж, следовательно, можно составить пропорцию:
817 кДж выделяется при при использовании 16,8 г Fe;
х кДж выделяется при использовании 111,7 г Fe;
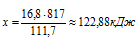
Подходит ответ № 3.
Ответ: Q = 122,88 кДж.
Задача 1.12
На каталитическое окисление 5 л оксида серы (IV) до оксида серы (VI) расходуется кислород объемом: 1) 2,5 л; 2) 5 л; 3) 7,5 л; 4) 10 л.
Дано: объем оксида серы (IV) (н.у.): V(SО2) = 5 л.
Найти: объем кислорода (н.у.): V(О2) = ?
Решение:
В первую очередь необходимо составить уравнение реакции:
2SО2 + О2 = 2SО3
п = 2 моль п =1 моль
Применяем закон объемных отношений:
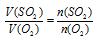
Отношение 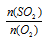 мы находим по уравнению реакции, а V(SO2) возьмем из условия. Подставив все эти значения в закон объемных отношений, получим:
мы находим по уравнению реакции, а V(SO2) возьмем из условия. Подставив все эти значения в закон объемных отношений, получим:
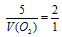
Отсюда: V(O2) = 5/2 = 2,5л.
Подходит ответ № 1.
Без использования закона объемных отношений задача решается с помощью расчета по уравнению:
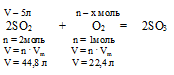
Составляем пропорцию:
5 л SO2 взаимодействуют с х л О2 (по условию)
44,8 л SО2 взаимодействуют с 22,4 л О2(по уравнению)
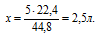
Получили тот же вариант ответа № 1.
Ответ: V(O2) = 2,5л.
Задача 1.13
Объем кислорода, необходимый для сгорания 2 л пропана равен:
1) 2 л; 2) 4 л; 3) 6 л; 4) 10 л.
Дано:
объем пропана(н.у.): V(С3Н8) = 2 л.
Найти: объем кислорода (н.у.): V(О2) = ?
Решение :
В первую очередь необходимо составить уравнение реакции:
2С3Н8 + 10О2 = 6СО2 + 8Н2О.
n= 2 моль n =10 моль
Применяем закон объемных отношений:
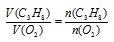
Отношение 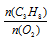 мы находим по уравнению реакции, а V(С3Н8) возьмем из условия. Подставив все эти значения в закон объемных отношений, получим:
мы находим по уравнению реакции, а V(С3Н8) возьмем из условия. Подставив все эти значения в закон объемных отношений, получим:
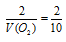
Отсюда: V(O2) = 2 . 10/2 = 10л.
Подходит ответ № 4.
Без использования закона объемных отношений задача решается с помощью расчета по уравнению:
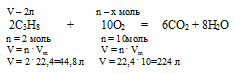
Составляем пропорцию:
2 л С3Н8 взаимодействуют с х л О2 (по условию)
44,8 л С3Н8 взаимодействуют с 224 л О2(по уравнению)
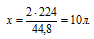
Получили тот же вариант ответа № 4.
Ответ: V(O2) = 10 л.
Задачи на определение теплового эффекта реакции:
1. Теплота образования вещества
2. Количесттво теплоты
3. Зависимость теплового эффекта от температуры

