Правильный расчет теплового эффекта реакций и теплот образования веществ
Тепловой эффект реакции
Задание 95.
Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 15/2О2(г) = 6СО2(г) + 3Н2О(г);  =?
=?
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования бензола равна +33,9 кДж. Ответ: —3135,58 кДж.
Решение:
∆H°С6Н6(парообр.) = +33,9 кДж/моль;
∆H°С6Н6(г) = +82,9 кДж/моль;
∆H°Н2О = -241,98 кДж/моль;
∆H°СО2 = -393,51 кДж/моль;
(С6Н6(ж) → (С6Н6(г); ∆H = +33,9 кДж;
ΔН = ?
Зная мольную теплоту парообразования и мольную теплоту образования газообразного бензола, рассчитаем мольную теплоту образования жидкого бензола из соотношения:
∆H°С6Н6(ж) = ∆H°С6Н6(парообр.) - ∆H°С6Н6(г) - =
= 82,9 - 33,9 = 49 кдж/моль.
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
∆H°х.р. = ∑∆H°(прод.) - ∑∆H°(исходн.);
∆H°х.р. = 3∆H°(Н2O) + ∆H°СО2 – ∆H°С6Н6(ж);
∆H°х.р. = 6(-393,51) +3(-241,98) – 49 = -3136 кДж.
Ответ: ΔН = -3136 кДж.
Задание 96.
Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моля этана С2Н6(г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в пересчете на нормальные условия? Ответ: 63742,86 кДж.
Решение:
Уравнение реакции горения этана имеет вид:
С2Н6 (г) + 31/2O2 = 2СО2(г) + 3Н2О (ж);  = ?
= ?
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
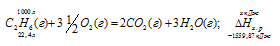
Рассчитаем теплоту, выделяющуюся при сжигании 1м3 этана из пропорции:
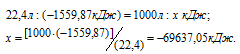
Ответ: Q = 69637,05 кДж.
Теплота образования вещества
Задание 97.
Реакция горения аммиака выражается термохимическим уравнением:
4NH3(г) + 3O2 (г) = 2N2(г) + 6Н2O(ж);  = —1530,28 кДж. Вычислите теплоту образования NH3 (г). Ответ: —46,19 кДж/моль.
= —1530,28 кДж. Вычислите теплоту образования NH3 (г). Ответ: —46,19 кДж/моль.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном дав-лении Qp равные изменению энтальпии системы  . Значение
. Значение  приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жид-кое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жид-кое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Термохимическое уравнение реакции имеет вид:
4NH3(г) + 3O2 (г) = 2N2(г) + 6Н2O(ж);  = —1530,28 кДж.
= —1530,28 кДж.
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:
 = 6
= 6 (6Н2O(ж)) – 4
(6Н2O(ж)) – 4 (NH3(г))
(NH3(г))
Отсюда вычислим теплоту образования NH3:
4 (NH3(г)) = 6
(NH3(г)) = 6 (6Н2O(ж)) –
(6Н2O(ж)) –  ;
;
4 (NH3(г)) = [(-285,84) – (–1530,28кДж);
(NH3(г)) = [(-285,84) – (–1530,28кДж);
4 (NH3(г)) = –184,76кДж;
(NH3(г)) = –184,76кДж;
 (NH3(г)) = –184,7/4 = —46,19 кДж/моль.
(NH3(г)) = –184,7/4 = —46,19 кДж/моль.
Ответ: –46,19 кДж/моль.
Задание 98.
При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа ЕеS. Ответ: —100,26 кДж/моль.
Решение:
Уравнение реакции имеет вид:
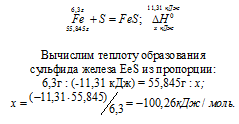
Ответ: —100,26 кДж/моль.
Задание 99.
При сгорании 1 л ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксида углерода. Вычислите теплоту образования С2Н2(г). Ответ. 226,75 кДж/моль.
Решение:
Уравнение реакции горения ацетилена имеет вид:
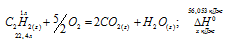
Рассчитаем теплоту, выделяющуюся при сжигании 1моль ацетилена из пропорции:
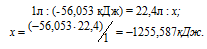
Термохимическое уравнение реакции горения ацетилена будет иметь вид:
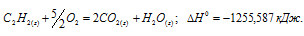
Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:
 = 6
= 6 (СО2) + 3
(СО2) + 3 (Н2О) –
(Н2О) –  (С6Н6)
(С6Н6)
Отсюда вычислим теплоту образования С2Н2:
 (С2Н2) = [2
(С2Н2) = [2 (СО2) +
(СО2) +  (Н2О)] - ;
(Н2О)] - ;
 (С2Н6) = [2 -393,51) + (-241,83)] – (–1255,587) =
(С2Н6) = [2 -393,51) + (-241,83)] – (–1255,587) =
= 226,75кДж.
Ответ: 226,75 кДж/моль.
Задание 100.
При получении молярной массы эквивалента гидроксида кальция из СаО(к) и Н2О(ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. Ответ: –635,6 кДж.
Решение:
Так как молярная масса эквивалента гидроксида кальция равна 1/2M(Са(ОН)2), то при по-лучении 1моль его выделится 65,06 кДж теплоты (2 . 32,53 = 65,06).
Термохимическое уравнение получения гидроксида кальция из СаО(к) и Н2О(ж) будет иметь вид:
СаО(к) + Н2О(ж) = Са(ОН)2(к);  = 65,06 кДж.
= 65,06 кДж.
Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:
 =
=  (Са(ОН)2(к)) –
(Са(ОН)2(к)) – [(СаО(к)) +
[(СаО(к)) +  (Н2О(ж))].
(Н2О(ж))].
Отсюда вычислим теплоту образования С2Н2:
 ( СаО(к)) = [
( СаО(к)) = [ (Са(ОН)2(к)) +
(Са(ОН)2(к)) +  (Н2О(ж))] -
(Н2О(ж))] -  ;
;
 ( СаО(к)) = [-986,6) - (-285,84) - (65,06)] – = –635,6 кДж.
( СаО(к)) = [-986,6) - (-285,84) - (65,06)] – = –635,6 кДж.
Ответ: –635,6 кДж/моль.

