Как рассчитать количество теплоты, тепловой эффект и теплоту образования
Количество теплоты
Задание 81.
Вычислите количество теплоты, которое выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. Ответ: 2543,1 кДж.
Решение:
Уравнение реакции:
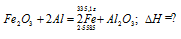
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим:
 =
=  (Al2O3) -
(Al2O3) -  (Fe2O3) =
(Fe2O3) =
= -1669,8 -(-822,1) = -847,7 кДж.
Вычисление количества теплоты, которое выделяется при получении 335,1 г железа, про-изводим из пропорции:
(2 . 55,85) : -847,7 = 335,1 : х; х =
= (0847,7 . 335,1)/ (2 . 55,85) =
= 2543,1 кДж, где
55,85 атомная масс железа.
Ответ: 2543,1 кДж.
Тепловой эффект реакции
Задание 82.
Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Ответ: -45,76 кДж.
Решение:
Уравнение реакции имеет вид:
С2Н4 (г) + Н2О (г) = С2Н5ОН (г);  = ?
= ?
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим:
 =
=  ( С2Н5ОН) – [
( С2Н5ОН) – [ ( С2Н4) +
( С2Н4) +  ( Н2О)] =
( Н2О)] =
= -235,1 -[(52,28) + (-241,83)] =
= - 45,76 кДж.
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы  . Значение
. Значение  приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Если в результате реакции выделяется теплота, то  < О. Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции:
< О. Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции:
С2Н4 (г) + Н2О (г) = С2Н5ОН (г);  = - 45,76 кДж.
= - 45,76 кДж.
Ответ: - 45,76 кДж.
Задание 83.
Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
а) FeО (к) + СО (г) = Fe (к) + СO2 (г); = -13,18 кДж;
б) СO (г) + 1/2O2 (г) = СO2 (г); = -283,0 кДж;
в) Н2 (г) + 1/2O2 (г) = Н2O (г); = -241,83 кДж.
Ответ: +27,99 кДж.
Решение:
Уравнение реакции восстановления оксида железа (II) водородом имеет вид:
FеО (к) + Н2 (г) = Fe (к) + Н2О (г);  = ?
= ?
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:
 =
=  (Н2О) –
(Н2О) – [ (FeO)
[ (FeO)
Теплота образования воды определяется уравнением
Н2 (г) + 1/2O2 (г) = Н2O (г);  = -241,83 кДж,
= -241,83 кДж,
а теплоту образования оксида железа (II) можно вычислить, если из уравнения (б) вычесть уравнение (а).
Тогда
 =
= (в) -
(в) -  (б) -
(б) -  (а) =
(а) =
= -241,83 – [-283,o – (-13,18)] = +27,99 кДж.
Ответ: +27,99 кДж.
Задание 84.
При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод СS2 (г). Напишите термохимическое уравнение этой реакции, предварительно вычислите ее тепловой эффект. Ответ: +65,43 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
2H2S (г) + CO2 (г) = 2Н2О (г) + СS2 (г);  = ?
= ?
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:
 =
=  (Н2О) +
(Н2О) + (СS2) – [
(СS2) – [ (Н2S) +
(Н2S) +  (СO2)];
(СO2)];
 = 2(-241,83) + 115,28 – [2(-20,15) + (-393,51)] =
= 2(-241,83) + 115,28 – [2(-20,15) + (-393,51)] =
= +65,43 кДж.
Термохимическое уравнение будет иметь вид:
2H2S (г) + CO2 (г) = 2Н2О (г) + СS2 (г);  = +65,43 кДж.
= +65,43 кДж.
Ответ: +65,43 кДж.
Tермохимическое уравнение реакции
Задание 85.
Напишите термохимическое уравнение реакции между СО (г) и водородом, в результате которой образуются СН4 (г) и Н2О (г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? Ответ: 618,48 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — кое, к — кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
СО (г) + 3Н2 (г) = СН4 (г) + Н2О (г);  = ?
= ?
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:
 =
=  (Н2О) +
(Н2О) +  (СН4) –
(СН4) –  (СO)];
(СO)];
 = (-241,83) + (-74,84) – (-110,52) =
= (-241,83) + (-74,84) – (-110,52) =
= -206,16 кДж.
Термохимическое уравнение будет иметь вид:
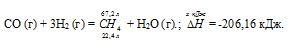
22,4 : -206,16 = 67,2 : х;
х = 67,2 (-206,16)/22?4 =
= -618,48 кДж; Q = 618,48 кДж.
Ответ: 618,48 кДж.
Теплота образования
Задание 86.
Тепловой эффект какой реакции равен теплоте образования. Вычислите теплоту образования NO, исходя из следующих термохимических уравнений:
а) 4NH3 (г) + 5О2 (г) = 4NO (г) + 6Н2O (ж);  = -1168,80 кДж;
= -1168,80 кДж;
б) 4NH3 (г) + 3О2 (г) = 2N2 (г) + 6Н2O (ж);  = -1530,28 кДж
= -1530,28 кДж
Ответ: 90,37 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование NO из простых веществ можно представить так:
1/2N2 + 1/2O2 = NO
Дана реакция (а), в которой образуется 4 моль NO и дана реакция (б), в которой образуется 2 моль N2. В обеих реакциях участвует кислород. Следовательно, для определения стандартной теплоты образования NO составим следующий цикл Гесса, т. е. нужно вычесть уравнение (а) из уравнения (б):
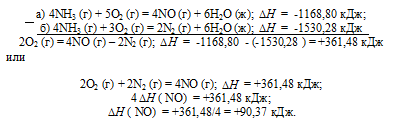
Таким образом, 1/2N2 + 1/2O2 / = NO;  = +90,37 кДж.
= +90,37 кДж.
Ответ: 618,48 кДж.
Задание 87.
Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлороводорода. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие кое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
NH3 (г) + НCl (г) = NH4Cl (к).;  = ?
= ?
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствиие из закона Гесса:
 =
=  ( NH4Cl) – [
( NH4Cl) – [ (NH3) +
(NH3) +  (HCl)];
(HCl)];
 = -315,39 – [-46,19 + (-92,31) = -176,85 кДж.
= -315,39 – [-46,19 + (-92,31) = -176,85 кДж.
Термохимическое уравнение будет иметь вид:
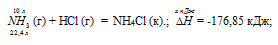
Теплоту, выделившуюся при реакции 10 л аммиака по этой реакции, определим из про-порции:
22,4 : -176,85 = 10 : х; х = 10 (-176,85)/22,4 =
= -78,97 кДж; Q = 78,97 кДж.
Ответ: 78,97 кДж.

