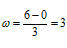Составление энергетических схем образования молекул и ионов
Энергетические схемы образования молекулы и иона водорода
Задание 76.
Нарисуйте энергетическую схему образования молекулярного нона Н2– и молекулы Н2 по методу молекулярных орбиталей. Где энергия связи больше? Почему?
Решение:
а) Энергетическая схема образования молекулярного иона Н2-:
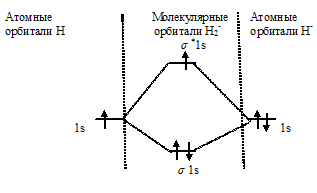
Определим порядок связи:
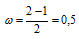
Так как порядок связи равен 0,5, то ион Н2- должен быть энергетически устойчивым, по-скольку здесь из трёх электронов, которые должны разместиться на МО, два займут связывающую ( 1s), а один – разрыхляющую ( *1s) МО. Следовательно, образование иона Н2- будет сопровождаться выделением энергии. Действительно ионы Н2- экспериментально получены.
б) Энергетическая схема образования молекулы Н2:
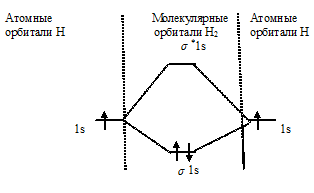
Определим порядок связи:
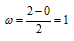
Так как порядок связи равен 1, то молекула Н2 может существовать. Энергия связи в молекуле Н2 больше, чем в молекулярном ионе Н2¯, так как порядок связи молекулы водорода больше Н2, чем в молекулярном ионе Н2-.
Метод валентных связей
Задание 77.
Какие электроны атома бора участвуют в образовании ковалентных связей? Как метод валентных связей (ВС) объясняет симметричную треугольную форму молекулы ВЕ3?
Решение:
Атом бора на внешнем энергетическом уровне содержит два s- и один р-электрон (2s22p1). В нормальном состоянии бор проявляет ковалентность равную 1, за счёт неспаренного р-электрона может образовать ковалентную связь по обычному механизму. В возбуждённом состоянии у атома бора 2s-электрон переходит на вакантную 2р-орбиталь и при этом об-разуется три неспаренных электрона (2s12p2):
Заполнение внешнего энергетического уровня атома бора в основном состоянии:
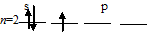
При таком состоянии валентность (спинвалентность) атома бора равна 1.
Заполнение внешнего энергетического уровня атома бора в возбуждённом состоянии:
![]()
При таком состоянии валентность (спинвалентность) атома бора равна 3.
Атом бора образует молекулу фторида бора BF3 за счёт перекрывания электронных орбиталей, занятых неспаренными электронами, с электронными орбиталями фтора. При этом у атома бора сохраняется одна вакантная орбиталь, за счёт которой по донорно-акцепторному механизму может образовать четвёртую связь.
В атоме бора происходит гибридизация одной s-орбитали и двух р-орбиталей. В этом случае в результате линейной комбинации трёх исходных орбиталей возникают три гибридные sp2-орбитали. При перекрывании sp2-орбиталей атома бора с орбиталями трёх атомов фтора образуются три связи, равноценные по длине и энергии. Они располагаются на одной плоскости под углом 1200 друг к другу. Молекулы, в которых валентные орбитали центрального атома находятся в состоянии sp2-гибридизации, имеют форму плоского треугольника.
Энергетические схемы образования молекул кислорода, фтора и азота
Задание 78.
Нарисуйте энергетическую схему образования молекулы О2 по методу молекулярных орбиталей (МО). Как метод МО объясняет парамагнитные свойства молекулы кислорода?
Решение:
С позиций метода МО электронное строение молекулы О2 можно представить так:
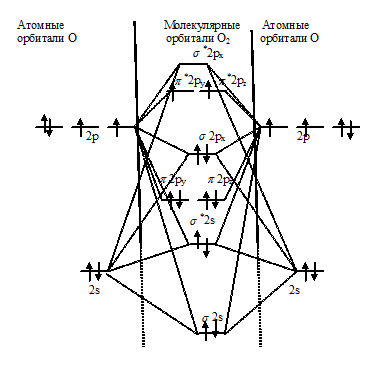
Из энергетической схемы образования молекулы О2 следует, что она парамагнитна, так как на *2ру и *2рz имеются неспаренные электроны
Задание 79.
Нарисуйте энергетическую схему образования молекулы F2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле?
Решение:
С позиций метода МО электронное строение молекулы F2 можно представить так:
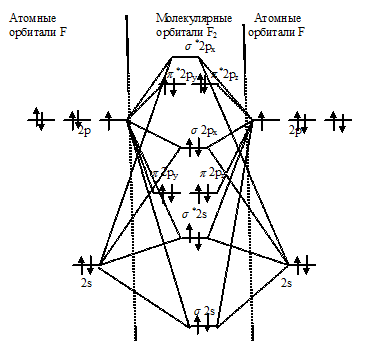
Из энергетической схемы образования молекулы F2 следует, что на связывающих орбиталях находится шесть электронов, а на разрыхляющих – четыре спаренных электрона. Порядок связи равен разности чисел электронов на связывающих и разрыхляющих орбиталях, делённой на два. В молекуле фтора порядок связи равен единице:
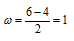
Задание 80.
Нарисуйте энергетическую схему образования молекулы N2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле?
Решение:
С позиций метода МО электронное строение молекулы N2 можно представить так:
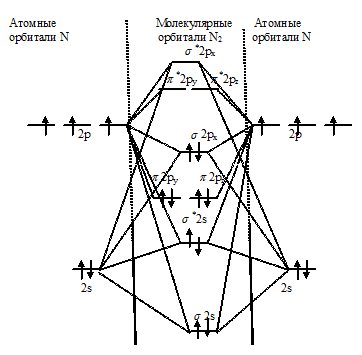
Из энергетической схемы образования молекулы N2 следует, что на связывающих орбиталях находится шесть электронов, а на разрыхляющих – ни одного. Порядок связи равен разности чисел электронов на связывающих и разрыхляющих орбиталях, делённой на два. В молекуле азота порядок связи равен трём: