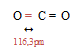Кристаллические структуры. Электронное строение атомов
Распределение электронов по квантовым ячейкам атома
Задание 66.
Сколько не спаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами?
Решение:
Распределение электронов внешнего энергетического уровня … 3s23p5 (учитывая правило Хунда 3s23px23py23pz1) по квантовым ячейкам имеет вид:
а) Заполнение внешнего энергетического уровня атома хлора в основном состоянии:
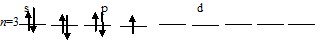
При таком состоянии валентность (спинвалентность) атома углерода равна 1.
б) Заполнение внешнего энергетического уровня атома хлора в возбуждённом состоянии при переходе одного 3py-электрона на d-подуровень:
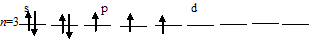
При таком состоянии валентность (спинвалентность) атома углерода равна 3.
в) Заполнение внешнего энергетического уровня атома хлора в возбуждённом состоянии при переходе одного 3py- и одного 3px-электрона на d-подуровень:
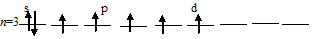
При таком состоянии валентность (спинвалентность) атома углерода равна 5.
г) Заполнение внешнего энергетического уровня атома хлора в возбуждённом состоянии при переходе одного 3py-, одного 3px- и одного s-электрона на d-подуровень:
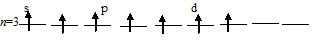
При таком состоянии валентность (спинвалентность) атома углерода равна 7.
Заполнение внешнего энергетического уровня атома
Задача 67.
Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами?
Решение:
Распределение электронов внешнего энергетического уровня атома серы … 3s23p4 (учитывая правило Хунда 3s23px23py13pz1) по квантовым ячейкам имеет вид:
а) Заполнение внешнего энергетического уровня атома серы в основном состоянии:
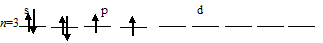
При таком состоянии валентность (спинвалентность) атома серы равна 2.
б) Заполнение внешнего энергетического уровня атома серы в возбуждённом состоянии при переходе одного 3py-электрона на d-подуровень:
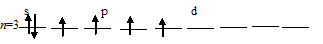
При таком состоянии валентность (спинвалентность) атома серы равна 4.
в) Заполнение внешнего энергетического уровня атома серы в возбуждённом состоянии при переходе одного 3py- и одного s-электрона на d-подуровень:
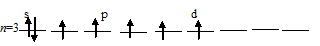
При таком состоянии валентность (спинвалентность) атома серы равна 6.
Электрический момент диполя
Задача 68.
Что называют электрическим моментом диполя? Какая из молекул НСI, НВг, НI имеет наибольший момент диполя? Почему?
Решение:
Ковалентная связь, которая образована разными атомами, называется полярной. Например, H — Cl; центр тяжести отрицательного заряда (связанного с электронами) не совпадает с центром тяжести положительного заряда (связанного с зарядом ядра атома). Электронная плотность общих электронов смещена к одному из атомов, имеющего большее значение электроотрицательности, в большей степени. В H : Cl общая электронная пара смещена в сторону наиболее электроотрицательного атома хлора. Полярность связи количественно оценивается дипольным моментом (D), который является произведением длины диполя (l) – расстояния между двумя равными по величине и противоположными по знаку зарядами +g и –g на абсолютную величину заряда. Дипольный момент - величина векторная и направлен по оси диполя от отрицательного заряда к положительному. Дипольный момент связи даёт ценную информацию о поведении молекулы в целом. Он служит количественной мерой её полярности. Молекула, тем более полярна, чем больше смещена общая электронная пара к одному из атомов, т. е. чем выше эффективные заряды атомов и чем больше длина диполя l. Поэтому в ряду сходно построенных молекул дипольный момент возрастает по мере увеличения разности электроотрицательностей атомов, образующих молекулу. Например, дипольные моменты в ряду НСI —НВг — НI будут уменьшаться, что связано с уменьшением разности электроотрицательности атомов при переходе от НСI, НВг, НI. Следовательно молекула НСI имеет наибольший момент диполя. Дипольные моменты НСI, НВг, НI равны, соответственно 1,04; 0,79; 0,38 D. Дипольные моменты молекул обычно измеряют в дебаях (D)* : 1D = 3,33 . 10-30 Кл . м.
Ионные, атомные, молекулярные, металлические кристаллические решетки
Задание 69.
Какие кристаллические структуры называют ионными, атомными, молекулярными и металлическими? Кристаллы, каких веществ - алмаз, хлорид натрия, диоксид углерода, цинк - имеют указанные структуры?
Решение:
а) Кристаллическая структура, в узлах которой находятся анионы и катионы называется ионной. Расстояния между противоположно заряжёнными ионами меньше, чем расстояния между одноимёнными ионами, поэтому электростатические силы межионного притяжения преобладают над силами отталкивания. Так электростатические силы не обладают ни насыщенностью, ни направленностью. Каждый ион взаимодействует не только с иона-ми своего непосредственного окружения, но и со всеми другими ионами кристалла. Эффективные заряды ионов в кристаллах с ионной кристаллической решёткой всегда боль-ше, поэтому кулоновское взаимодействие остаётся сильным и создаёт строго упорядоченное чередование катионов и анионов в пространстве, т. е. ионную решётку. К числу ионных кристаллических решёток относится решётка NaCl. В кристалле NaCl восемь хлорид-ионов образуют восемь вершин куба, а шесть других хлорид-ионов лежат в центрах шести граней этого куба. Таким образом, хлорид-ионы образуют кубическую гранецентрированную решётку. Меньшие по размерам катионы натрия занимают октаэдрические пустоты в решётке, образованной хлорид-ионами. Решётка образованная катионами натрия, также является кубической гранецентрированной. В данной кристаллической решётке каждый катион натрия окружён шестью хлорид-ионами, а каждый хлорид-ион окружает шесть катионов натрия, т. е. координационное число обоих ионов равно шести.
б) Атомной кристаллической структурой называется кристалл, в узлах решётки которого находятся атомы. Связь в таких кристаллах чисто ковалентная. Например, в алмазе каждый атом углерода имеет четыре -связи и тетраэдрически окружён четырьмя такими же атомами углерода. Углерод в алмазе находится в состоянии sp3-гибридизации, поэтому все связи между атомами в алмазе одинаковы (длина - связи равна 154 пм), а угол меж-ду атомами равен 109,50. Каждый атом углерода связан с четырьмя другими.
в) Кристаллические структуры, в узлах решеток которых находятся молекулы, называются молекулярными кристаллами. Взаимное притяжение в данных кристаллах между молекулами обусловлено или слабыми ван-дер-вальсовыми силами, или водородными связями, которые гораздо слабее сил, действующих в ионных, атомных и металлических кристаллах. Так, в узлах кристаллического СО2 («сухой лёд») содержатся молекулы СО2, которые плотно упакованы в гранецентрированную кристаллическую решётку. Между молекулами СО2 в кристалле действуют ван-дер-вальсовы силы.
г) Металлическая кристаллическая структура – это такая решётка, структурной единицей которой является атом. В кубических решётках каждый атом окружён восемью другими атомами (кубическая объёмноцентрированная решётка), а в других – двенадцатью (гексагональная решётка). Таким образом, каждый атом может образовывать со своими непосредственными соседями 8 или 12 связей, располагая для этого обычно небольшим числом валентных электронов. В этих условиях возникает большое число многоцентровых орбиталей с малым числом электронов на них. Орбитали охватывают значительное число атомов, они делокализованы. Электроны на этих орбиталях обобществлены сразу многими атомами.
Таким образом, кристаллические решётки металлов образуются положительно заряжёнными катионами и «погружены» в электронный газ. Валентные электроны в пределах металлического металла перемещаются почти свободно. Электронный газ компенсирует силы электростатического отталкивания положительных ионов и является причиной устойчивости, прочности металлического состояния. Концентрация свободных электронов в электронном газе металлов составляет 1022 – 1023 электронов в 1 см3. Металлическую кристаллическую структуру имеет и цинк, как металл.
Метод валентных связей (ВС)
Задание 70.
Как метод валентных связей (ВС) объясняет угловое строение молекулы Н2S и линейное молекулы СО2?
Решение:
а) Сера в основном состоянии имеет два неспаренных р-электрона (3s23px23py13pz1). Вследствие электростатического отталкивания два р-электронных облака всегда располагаются перпендикулярно друг другу. При образовании молекулы H2S два p-облака атома серы перекрываются с s-облаками атомов водорода, образуя две ковалентные связи, угол между которыми близок к 900 (рис.1.), что хорошо согласуется с взаимным расположением двух р-орбиталей. занятых неспаренными электронами.
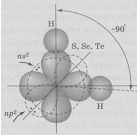
Рис.1.Схема перекрывания электронных облаков в молекулах
соединений водорода с серой, селеном,теллуром.
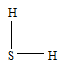
Таким образом, молекула H2S имеет угловое строение, что можно представить структурной формулой:
б) Углерод в основном состоянии имеет два неспаренных р-электрона (2s22px12py12pz0). Вследствие электростатического отталкивания два р-электронных облака всегда располагаются перпендикулярно друг другу, т. е. углерод в основном состоянии может быть двухвалентным. Молекула СО2 содержит на один атом углерода два атома кислорода, т.е. углерод с двумя атомами кислорода соединён посредством четырёх ковалентных связей. Установлено, что СО2 имеет линейное строение. Такая форма молекулы СО2 объясняется тем, что в атоме углерода две sp-гибридные орбитали и две негибридные орбитали. Все они перекрываются с р-орбиталями атомов кислорода. При этом две sp-гибридные орбитали дают с р-орбиталями каждого атома кислорода две  -связи, угол между которыми равен 1800 (рис.2.). Негибридизированные две р-орбитали атома углерода дают с р-орбиталями каждого атома кислорода две
-связи, угол между которыми равен 1800 (рис.2.). Негибридизированные две р-орбитали атома углерода дают с р-орбиталями каждого атома кислорода две  -связи, расположенных в перпендикулярных друг другу плоскостях.
-связи, расположенных в перпендикулярных друг другу плоскостях.
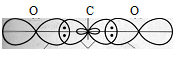
Рис. 2. Трёхатомная молекула СО2.
Структурная формула СО2 имеет вид: