Определение геометрической структуры молекул и типа гибридизации атомов
Геометрическая конфигурация молекул BF3 и NF3
Задача 265.
Одинакова ли геометрическая конфигурация молекул BF3 и NF3: а) одинакова; б) различна?
Потому что: 1) ковалентность центрального атома в обеих молекулах одинакова; 2) одна из молекул полярна, а другая нет.
Решение:
а) В молекуле BF3 валентный электронный слой атома бора содержит три пары электронов:
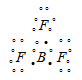
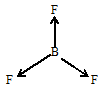
Поэтому электронные облака атома бора будут максимально удалены друг от друга при sp2-гибридизации, когда их оси расположены в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 1200, т.е. в направлениях к вершинам правильного треугольника. При этом дипольные моменты связей B—F взаимно компенсируют друг друга, так что суммарный дипольный момент молекулы будет равен нулю. Это можно представить схемой:
В молекуле NF3 валентный электронный слой атома азота содержит четыре пары электронов:
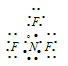
Поэтому электронные облака атома азота будут максимально удалены друг от друга при sp3-гибридизации, когда их оси направлены к вершинам тетраэдра. При образовании молекулы NF3 атомы фтора занимают только три вершины тетраэдра, а к четвёртой – направлено электронное облако неподелённой пары электронов атома азота. Это можно представить следующей схемой:
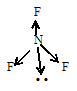
Образовавшаяся фигура – тригональная пирамида с атомом азота в её вершине и тремя атомами фтора в вершинах её основания. Дипольный момент молекулы NF3 не равен нулю, потому что не происходит компенсации дипольных моментов отдельных связей N—F.
Таким образом, геометрическая конфигурация молекул BF3 и NF3 не одинакова, потому что одна из молекул полярна, а другая нет.
Ответ: б)2.
Определение дипольного момента молекул BF3 и NН3
Задача 266.
В какой молекуле BF3 или NН3 значение дипольного момента больше: а) в BF3 б) в NН3; в) дипольные моменты равны?
Потому что: 1) разность электроотрицательностей атомов в молекуле BF3 больше, чем в молекуле NН3; 2) молекула BF3 имеет плоское строение, а молекула NН3 — пирамидальное; З) у атома азота есть неподеленная пара электронов, а у атома бора свободная (вакантная) валентная орбиталь.
Решение:
а) В молекуле BF3 валентный электронный слой атома бора содержит три пары электронов:
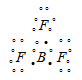
Поэтому электронные облака атома бора будут максимально удалены друг от друга при sp2-гибридизации, когда их оси расположены в направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 120 0, т.е. в направлениях к вершинам правильного треугольника. При этом дипольные моменты связей B—F взаимно компенсируют друг друга, так что суммарный дипольный момент молекулы будет равен нулю. Это можно представить схемой:

б) В молекуле NН3 валентный электронный слой атома азота содержит четыре пары электронов:
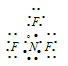
Поэтому электронные облака атома азота будут максимально удалены друг от друга при sp3-гибридизации, когда их оси направлены к вершинам тетраэдра. При образовании молекулы NН3 атомы водорода занимают только три вершины тетраэдра, а к четвёртой – направлено электронное облако неподелённой (вакантной) пары электронов атома азота. Это можно представить следующей схемой:

Образовавшаяся фигура – тригональная пирамида с атомом азота в её вершине и тремя атомами фтора в вершинах её основания. Дипольный момент молекулы NF3 больше нуля, потому что не происходит компенсации дипольных моментов отдельных связей N—F.
Таким образом, дипольный момент молекулы NН3 больше, чем в молекуле BF3, потому что молекула BF3 имеет плоское строение, а молекула NН3 — пирамидальное.
Ответ: б)2.
Гибридизация атомных орбиталей атома углерода
Задача 267.
Указать тип гибридизации АО углерода в молекуле диоксида углерода: а) sр-; б) sр2- в) sр3- г) нет гибридизации.
Потому что: 1) все валентные электроны атома углерода принимают участие в образовании связей; 2) атом углерода имеет два неспаренных электрона на 2р-орбиталях; З) молекула СО2 имеет линейное строение.
Решение:
В молекуле СО2 валентный электронный слой атома углерода содержит четыре пары электронов:
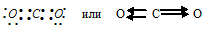
Электронные облака атома углерода будут максимально удалены друг от друга в случае sp-гибридизации, когда их оси направлены друг относительно друга в противоположных направлениях. При таком типе гибридизации молекула СО2 будет иметь линейное строение, в которой sp-гибридные орбитали образуют  - связи с атомом углерода и двумя атомами кислорода и
- связи с атомом углерода и двумя атомами кислорода и  - связи с p-орбиталями атома углерода и двух атомов кислорода.
- связи с p-орбиталями атома углерода и двух атомов кислорода.
Таким образом, линейное строение молекулы СО2 объясняется тем, что атом углерода в состоянии sp-гибридизации, и гибридные облака при этом располагаются друг относительно друга по одной оси и ориентированы в противоположных направлениях. Поэтому молекула СО2 имеет линейное строение, в которой каждый атом кислорода соединён с атомом углерода двойной связью, одна из которых  - связь, образованная за счёт sp-гибридной орбитали атома углерода и p-орбиталью атома кислорода, а вторая -
- связь, образованная за счёт sp-гибридной орбитали атома углерода и p-орбиталью атома кислорода, а вторая -  -с вязь, образованная за счёт перекрывания p-орбиталей атомов кислорода и углерода.
-с вязь, образованная за счёт перекрывания p-орбиталей атомов кислорода и углерода.
Ответ: 3.

