Как объяснить с позиций методов ВС и МО изменение энергии диссоциации (кДж/моль) молекул
Задача 246.
Объяснить с позиций методов ВС и МО изменение энергии диссоциации (кДж/моль) молекул в ряду: F2 (155) → O2 (493) → N2 (945).
Решение:
1) Метод ВС.
а) В молекуле F2 ковалентная химическая связь образуется двумя электронами от двух разных атомов фтора, причём электроны с противоположно направленными спинами. электронная пара расположена на одинаковом расстоянии от атомных ядер, потому что электроотрицательность атомов в молекулах простых веществ одинаковая, связь ковалентная неполярная. Перекрывание атомных орбиталей происходит на межъядерной оси, т.е. образуется  - связь (сигма-связь). Схемы перекрывания электронных облаков имеют вид:
- связь (сигма-связь). Схемы перекрывания электронных облаков имеют вид: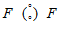 . Структурная формула имеет вид: F — F. Длина связи равна 0,142нм.
. Структурная формула имеет вид: F — F. Длина связи равна 0,142нм.
б) В молекуле О2 связь между двумя атомами кислорода образуется за счет перекрывания двух неспаренных электронов от двух разных атомов. При чем, одна связь образуется за счет перекрывания атомных орбиталей на межъядерной оси, т.е. образуется  - связи (сигма-связь). Вторая связь образуется за счет перекрывания АО по обе стороны линии, соединяющей ядра двух атомов кислорода (боковые перекрывания, называется
- связи (сигма-связь). Вторая связь образуется за счет перекрывания АО по обе стороны линии, соединяющей ядра двух атомов кислорода (боковые перекрывания, называется  - связь (пи-связь). При наложении
- связь (пи-связь). При наложении  - связи на
- связи на  - связь образуется двойная связь в молекуле кислорода. Хотя энергия
- связь образуется двойная связь в молекуле кислорода. Хотя энергия  -связи меньше, чем энергия
-связи меньше, чем энергия  - связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи. Схемы перекрывания электронных облаков имеют вид:
- связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи. Схемы перекрывания электронных облаков имеют вид: 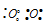 . Структурная формула имеет вид: О=О. Длина связи равна 0,121 нм.
. Структурная формула имеет вид: О=О. Длина связи равна 0,121 нм.
в) В молекуле N2 связь между двумя атомами азота образуется за счет перекрывания трёх неспаренных электронов от двух разных атомов. При чем, одна связь образуется за счет перекрывания атомных орбиталей на межъядерной оси, т. е. образуется  - связь (сигма-связь). Вторая и третья связь образуются за счет перекрывания АО по обе стороны линии, соединяющей ядра двух атомов азота, т.е. образуются две
- связь (сигма-связь). Вторая и третья связь образуются за счет перекрывания АО по обе стороны линии, соединяющей ядра двух атомов азота, т.е. образуются две  - связи. При наложении
- связи. При наложении  - связи на две
- связи на две  - связи образуется тройная связь в молекуле азота. Схемы перекрывания электронных облаков имеют вид:
- связи образуется тройная связь в молекуле азота. Схемы перекрывания электронных облаков имеют вид: 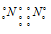 .
.
Структурная формула N2 имеет вид: 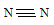 . Длина связи равна 0,11нм.
. Длина связи равна 0,11нм.
Энергия тройной связи выше, а длина связи ниже, чем энергии и длины простой и двойной связей.
Число связей между атомами в методе ВС называется кратностью связи, чем выше кратность связи, тем выше её энергия диссоциации.
2) Метод МО.
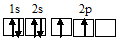
Энергетические схемы образования молекул в ряду F2, O2, N2:
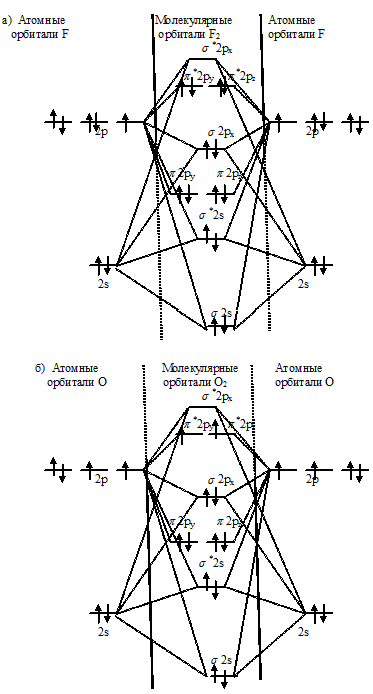
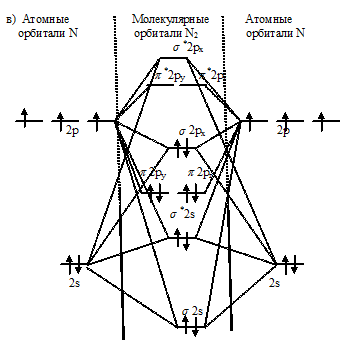
Как видно из энергетических схем в молекулах F2, O2 и N2 разность между числом связывающих и числом разрыхляющих электронов равна соответственно 2, 4 и 6, что отвечает кратности связи соответственно 1; 2, и 3. Следовательно, прочность связи в ряду F2 → O2 → N2 характеризуется повышением кратности, т.е. возрастанием прочности молекул данных веществ. Этот вывод соответствует экспериментально установленным значениям энергии диссоциации в ряду F2 → O2 → N2, их возрастанию.
Задача 247.
Энергия диссоциации молекул N2 и СО соответственно равна 945 и 1071 кДж/моль. Объяснить близость этих значений с позиций методов ВС и МО.
Решение:
а) Метод ВС.
Электронная конфигурация атома углерода 1s22s22p2 атома кислорода 1s22s22p4, атома азота 1s22s22p3. Электронное строение их валентных орбиталей в невозбуждённом состоянии может быть представлено следующими графическими схемами:
а) атома углерода:
б) атома кислорода:
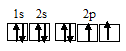
а) атома азота:
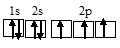
Для образования молекулы N2. Три неспаренных электрона атома азота могут участвовать в образовании трёх ковалентных связей по обычному механизму с другим атомом азота с образованием молекулы N2. Электронная схема молекулы азота имеет вид: 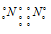
Атомы азота соединены друг с другом тремя ковалентными связями: 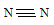
Два неспаренных электрона атома углерода и два неспаренных электрона атома кислорода могут образовать две ковалентные связи по обычному механизму. Валентная схема молекулы СО будет иметь вид: 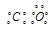
Структурная формула имеет вид: С=О.
Учитывая, что в СО две связи, а в молекуле N2 – три можно предположить большую прочность молекулы N2. Так как радиусы атомов углерода, кислорода и азота отличаются незначительно, то можно предположить близость значений энергий диссоциации СО и N2.
б) Метод МО.
Энергетические схемы образования молекул ряду а) СО и б) N2:
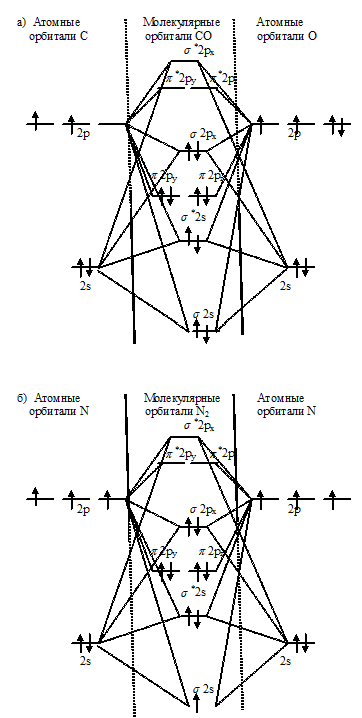
Как видно из энергетических схем в молекулах СО и N2 разность между числом связывающих и числом разрыхляющих электронов одинакова (6). Это отвечает кратности связи 3. Учитывая, что в молекулах кратность связи одинаковая, то можно предположит близость значений их энергий диссоциации.
Таким образом, метод МО более точно объясняет близость значений энергии диссоциации молекул, чем метод ВС.

