Описание электронного строения молекул с позиций методов валентных связей и молекулярных орбиталей
Задача 241.
Описать электронное строение молекул СО и СN с позиций методов ВС и МО. Какая из молекул характеризуется большей кратностью связи?
Решение:
а) Электронное строение молекул CO и CN с позиции метода ВС
Электронная конфигурация атома углерода 1s22s22p2, атома кислорода 1s22s22p4, атома азота 1s22s22p3. Электронное строение их валентных орбиталей в невозбуждённом состоянии может быть представлено следующими графическими схемами:
а) атом углерода:
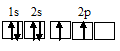
б) атом азота:
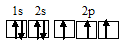
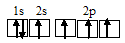
При возбуждении атом углерода переходит в состояние 1s22s12p3, а электронное строение его валентных орбиталей соответствует схеме:
Два неспаренных электрона невозбуждённого атома углерода могут участвовать в образовании двух ковалентных связей по обычному механизму с атомом кислорода, имеющем два неспаренных электрона, с образованием молекулы СО. При образовании молекулы CN образуются две ковалентные связи по обычному механизму за счёт двух неспаренных электрона атома углерода и двух неспаренных электронов атома азота. Электронные схемы CO и CN:
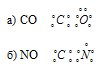
б) Электронное строение молекул CO и CN с позиции метода МО
Энергетические схемы образования молекул а) CO и б) CN:
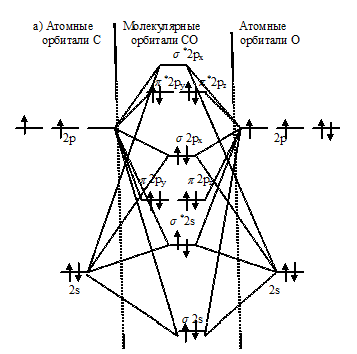

Из приведённых схем следует, что кратность связи в молекуле СО равна 3 [(6 - 0)/2 = 3], а в молекуле NO – 2,5[(5 – 0)/2 = 2,5]. Следовательно, молекула СО по отношению к молекуле NO характеризуется большей устойчивостью, чем больше кратность связи, тем короче связь. Молекула СN имеет один неспаренный электрон на связывающей орбитали, следовательно, она парамагнитна. Молекула СО не имеет неспаренных электронов на связывающих и разрыхляющих орбиталях, значит, она диамагнитна.
Задача 242.
Рассмотреть с позиций метода МО возможность образования молекул В2, F2, BF. Какая из этих молекул наиболее устойчива?
Решение:
Энергетические схемы образования молекул а)В2, б) F2, в) BF:
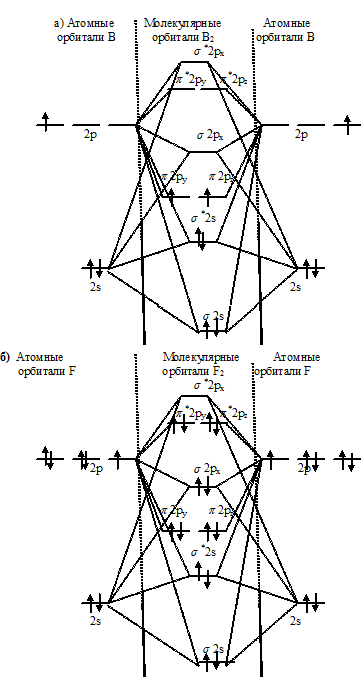
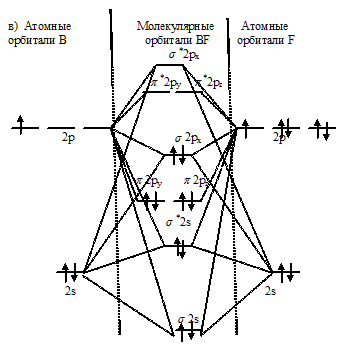
Из составленных энергетических схем В2, F2, BF вытекает, что разность между числом связывающих и разрыхляющих электронов соответственно равны 2, 2 и 6, что отвечает кратности связи соответственно 1, 1 и 3. Следовательно, молекула BF характеризуется большей кратностью связи между атомами, она должна быть более прочной, чем у В2 и F2.

