Вычисление разности относительных электроотрицательностей атомов
Задача 233.
Вычислить разность относительных электроотрицательностей атомов для связей Н — О и О —Г (где Г — это Сl, Вг, I) в соединениях НОГ и определить: а) какая из связей в каждой молекуле характеризуется большей степенью ионности; б) каков характер диссоциации молекул в водном растворе.
Решение:
По данным таблицы «Относительная электроотрицательность элементов» вычисляем разность электроотрицательностей связей Н — О и О — Г:
 Н—О = 3,6 – 2,16 = 1,44;
Н—О = 3,6 – 2,16 = 1,44;
 О—Сl = 3,6 – 2,9 = 0,5;
О—Сl = 3,6 – 2,9 = 0,5;
 O—Br = 3,6 – 2,82 = 0,78;
O—Br = 3,6 – 2,82 = 0,78;
 Н—I = 3,6 – 2,28 = 1,32.
Н—I = 3,6 – 2,28 = 1,32.
Таким образом:
а) Связь Н — О в молекуле НОГ более полярна, чем связь О — Г, так как имеет большее значение  , т.е. характеризуется большей степенью ионности.
, т.е. характеризуется большей степенью ионности.
б) Диссоциация молекул НОГ в водном растворе будет осуществляться по наиболее ионной связи Н — О в соответствии со схемой:
HOГ ⇔ H+ + ОГ-
Следовательно, все рассмотренные соединения будут диссоциировать по типу кислот.
Задача 234.
Вычислить разность относительных электроотрицательностей атомов для связей Н—О и О—As. Какая из связей более полярна? К какому классу гидроксидов относится As(ОН)3?
Решение:
По данным таблицы «Относительная электроотрицательность элементов» вычисляем разность электроотрицательностей связей Н — О и О — As:
 Н—О = 3,6 – 2,16 = 1,44;
Н—О = 3,6 – 2,16 = 1,44;

 O—As = 3,6 – 2,25 = 1,35.
O—As = 3,6 – 2,25 = 1,35.
Таким образом:
а) Связь Н—О более полярна ( Н—О >
Н—О >  O—As), т.е. характеризуется большей степенью ионности.
O—As), т.е. характеризуется большей степенью ионности.
б) Диссоциация As(ОН)3 на ионы в водных растворах будет протекать по наиболее ионной связи, т.е. по связи
Н—О:
As(ОН)3 ⇔ 3H+ +_ AsO3- .
Следовательно гидроксид мышьяка(III) As(ОН)3 будет диссоциировать по типу кислоты. As(ОН)3 – мышьяковистая кислота.
Задача 235.
Как изменяется прочность связи в ряду: НF — НС1 — НВг — НJ? Указать причины этих изменений.
Решение:
В связи с увеличением порядковых номеров в ряду F — Cl — Br — J валентных электронных облаков элементов возрастают, что приводит к уменьшению степени их перекрывания с электронным облаком атома водорода и к возрастающему удалению области перекрывания от ядра атома соответствующего элемента. Это вызывает ослабление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т.е. ослабление связи. К этому же результату приводит возрастающее экранирование ядер рассматриваемых элементов в ряду F — Cl — Br — J вследствие увеличения числа промежуточных электронных слоёв. Таки образом, при переходе от фтора к йоду в ряду F — Cl — Br — J прочность связи Н—Г уменьшается. К уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи Н—Г приводит и смещение водородного электронного облака к атому галогена, имеющему большее значение элетроотрицательности, которая закономерно уменьшается в ряду F — Cl — Br — J.
Задача 232.
Составить валентную схему молекулы хлороформа СНСI3 и указать: а) какая связь наиболее полярна; б) в каком направлении смещено электронное облако этой связи.
Решение:
Электронная схема молекулы СНСI3 имеет вид:
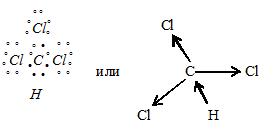
При соединении атома углерода, находящегося в возбуждённом состоянии, четыре неспаренных sp3-гибридных его электрона участвуют в образовании четырёх ковалентных связей по обычному ковалентному механизму с тремя атомами хлора и одним атомом водорода, имеющими по одному неспаренному электрону с образованием молекулы СНСI3.
Разность электроотрицательностей для связи C—Cl равна 0,33 ( = 2,9 – 2,57 = 0,33), а для связи С—Н – 0,41 (
= 2,9 – 2,57 = 0,33), а для связи С—Н – 0,41 ( = 2,57 – 2,16 = 0,41).
= 2,57 – 2,16 = 0,41).
Так как связь С—Н имеет большее значение  , чем связь C—Cl, то она является больше полярной (большая степень ионности); электронное облако связи С—Н будет смещено в сторону углерода, как более электроотрицательного элемента.
, чем связь C—Cl, то она является больше полярной (большая степень ионности); электронное облако связи С—Н будет смещено в сторону углерода, как более электроотрицательного элемента.

