"Химия. 8 класс". О.С. Габриелян
Электронные схемы образования ковалентной связи
Вопрос 1 (1). Электронная схема образования двухатомной молекулы галогена
Электронная схема образования двухатомной молекулы галогена будет выглядеть следующим образом:
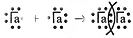
Общая структурная формула галогенов будет иметь вид:
НаI—НаI.
Вопрос 2 (2). Механизм образования ковалентной связи
а) Схема образования химической связи для KCl:
Калий — элемент 1 группы, его атому легче отдать 1 внешний электрон, чем принять недостающие 7 электронов.
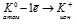
Хлор — элемент VII группы, его атому легче принять 1 недостающий электрон, чем отдать 7 электронов.
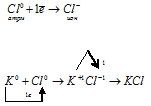
б) Схема образования химической связи для Cl2:
Связь между атомами одного и того же элемента ковалентная.
Вопрос 3 (3). Схема образования молекул S2
Сера — элемент главной подгруппы VI группы. Ее атомы имеют 6 электронов на внешнем уровне. Число непарных электронов равно 2(8—6). В молекулах S2 атомы связаны двумя общими электронными парами, поэтому связь двойная ковалентная.
Схема образования молекулы S2 будет выглядеть следующим образом:
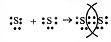
S=S
Вопрос 4 (4). Связи в молекулах азота, серы, хлора
В молекуле S2 связь двойная, в молекуле Cl2 связь одинарная, в молекуле N2 — тройная, поэтому самой прочной молекулой будет N2, менее прочной S2, а еще слабее Cl2. Длина связи самая маленькая в молекуле N2, больше в молекуле S2, еще больше в молекуле Cl2.
Вопрос 5 (5). Вещества с ковалентной и ионной связью
Вещества с ковалентной неполярной связью: N2, O2, H2. Вещества с ионной связью: Li2O, KCl, CaF2.

