Составление энергетических схем молекул, ионов, используя метод атомных орбиталей
Энергетические схемы образования молекул берилия и неона
Задача 243.
Почему не могут существовать устойчивые молекулы Ве2 и Ne2?
Решение:
Энергетические схемы образования молекул а) Be2, б) Ne2:
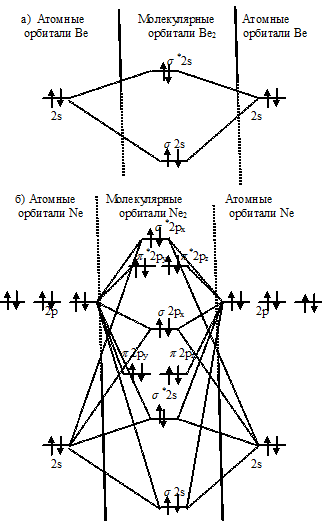
В молекуле Ве2 на МО два электрона занимают связывающую, а два – разрыхляющую орбитали. В молекуле Ne2 на МО шесть электронов занимают связывающие, а шесть разрыхляющие орбитали. Как видно из энергетических схем Ве2 и Ne2 в обеих молекулах разность между числом связывающих и числом разрыхляющих электронов равна нулю, что отвечает кратности связей 0. Следовательно, образование молекул Ве2 и Ne2 не будет сопровождаться выделением энергии. Действительно, молекулы Ве2 и Ne2 не существуют.
Энергетические схемы образования частиц - О22-, О2-, О2, О2+
Задача 244.
Как изменяются длина связи, энергия диссоциации и магнитные свойства в ряду: О22- ⇔ О2- ⇔ О2 ⇔ О2+. Ответ мотивировать.
Решение:
Энергетические схемы образования частиц О22- ⇔ О2- ⇔ О2 ⇔ О2+:
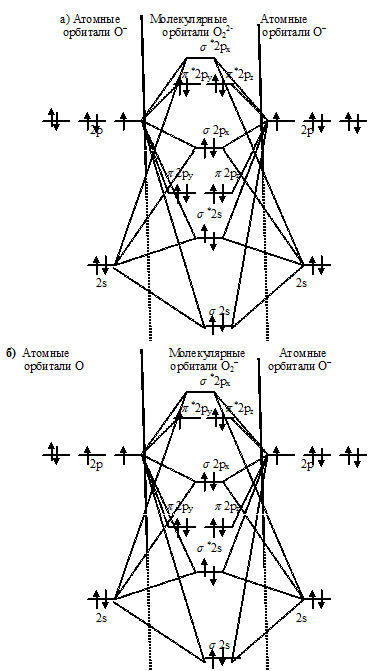
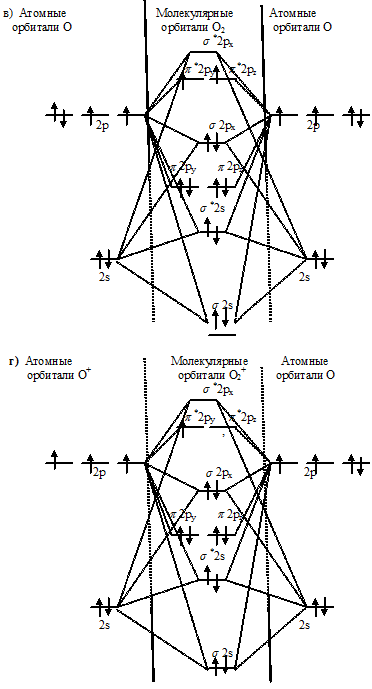
Как видно из энергетических схем в частицах О22- ⇔ О2- ⇔ О2 ⇔ О2+ разность между числом связывающих и числом разрыхляющих электронов равна соответственно 2, 3, 4 и 5, что отвечает кратности связи соответственно 1; 1,5; 2 и 2,5. Следовательно, длина связи в ряду: О22- ⇔ О2- ⇔ О2 ⇔ О2+ закономерно уменьшается, а энергия диссоциации с уменьшением (упрочнением) связи увеличивается. Частица О22- не имеет неспаренных электронов на связывающих и разрыхляющих орбиталях, вследствие чего она может быть диамагнитная. В частицах О2-, О2 и О2+ имеются неспаренные электроны на связывающих и разрыхляющих орбиталях соответственно 1, 2 и 1; вследствие чего они могут быть парамагнитные.
Энергетические схемы образования частиц — NO+, NO и NO-
Задача 245.
Какая из частиц — NO+, NO или NO- характеризуется наименьшей длиной связи?
Решение:
Энергетические схемы образования частиц NO+, NO или NO-:
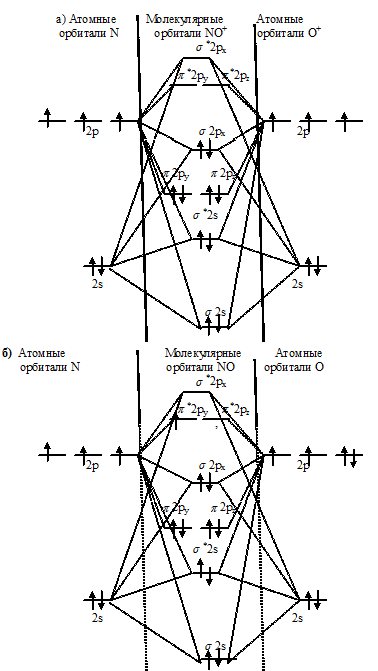
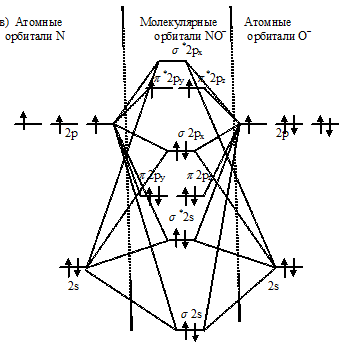
Как видно из энергетических схем в частицах NO+, NO, NO- разность между числом связывающих и числом разрыхляющих электронов равна соответственно 6, 5 и 4, что отвечает кратности связи соответственно 3; 2,5 и 2. Следовательно, частица NO характеризуется наименьшей длиной связи, кратность связи наименьшая (2).

