Соединения азота образованные связью по донорно-акцепторному механизму
Электронное строение молекулы N2 с позиций методов ВС и МО
Донорно-акцепторная связь
Задача 880.
Привести примеры соединений азота, в молекулах которых имеются связи, образованные по донорно-акцепторному механизму.
Решение:
Связь по донорно-акцепторному механизму (координационная связь) образуется за счёт обобществления электронной пары одного атома (донор) и вакантной орбитали другого атома (акцептор). Несвязывающая электронная пара атома азота 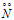 способна с ионом водорода, имеющим свободную атомную орбиталь
способна с ионом водорода, имеющим свободную атомную орбиталь 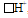 , образовывать ковалентную связь по донорно-акцепторному механизму. Так образуется катион аммония NH4+ из молекулы аммиака и иона водорода:
, образовывать ковалентную связь по донорно-акцепторному механизму. Так образуется катион аммония NH4+ из молекулы аммиака и иона водорода:
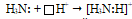
В результате образования донорно-акцепторной связи несвязывающая электронная пара атома азота становится связывающей, образуется четыре связи между одним атомом азота и четырьмя атомами водорода:
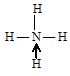
Все четыре связи равнозначны и по длине, и по энергии.
Такая связь идентична ковалентной связи, образованной по обычному механизму, обобществлению неспаренных электронов двух атомов.
У аммиака и его производных, за исключением тригалогенидов азота, сильно выражена электроно-донорная способность. Поэтому аммиак, также практически все соединения, имеющие аминогруппы и группы:
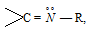
являются N-донорными лигандами, образующими комплексные соединения с катионами многих металлов. Имеются комплексы со следующими группами:
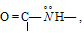
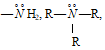
глицианат-ион:
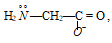
глицилглицилцианат-ион:
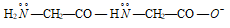
этилендиамин:
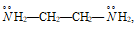
диэтилентриамин:
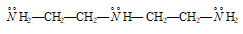
и др.. Связь в комплексных соединениях можно объяснить координационной связью между несвязывающими электронными парами атома азота лиганда и свободными орбиталями атома комплексообразователя, например, [Ag(NH3)2]Cl2, [Ni(en)2(NH3)2]Cl2 и др. В аммиаке 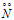 Н3 и аминах
Н3 и аминах 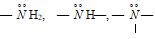 как производных аммиака. Атом азота может образовывать координационную связь, например: хлорид аммония NH4Cl, гидроксид метиламмония CH3—NH3—OH, иодид тетраметиламмония (CH3)4NI, гидроксид тетраэтиламмония (С2Н5)4NOH, гидроксид аммония NH4OH, хлорид фениламина С6Н5NH3+Cl. Некоторые
как производных аммиака. Атом азота может образовывать координационную связь, например: хлорид аммония NH4Cl, гидроксид метиламмония CH3—NH3—OH, иодид тетраметиламмония (CH3)4NI, гидроксид тетраэтиламмония (С2Н5)4NOH, гидроксид аммония NH4OH, хлорид фениламина С6Н5NH3+Cl. Некоторые
производные аммиака, например: гидразин: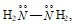 , гидроксиламин:
, гидроксиламин: 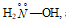 , а также хлорид гидразония N2H5Cl (+1), гидроксид гидразония N2H5(ОН)2 (+2), гидроксид гидроксиламмония [NH3OH]OH, гидроксид гидразония (+2) N2H6(OH)2, хлорид гидразония (+2) N2H6Cl2, хлорид гидроксиламмония NH3OHCl.
, а также хлорид гидразония N2H5Cl (+1), гидроксид гидразония N2H5(ОН)2 (+2), гидроксид гидроксиламмония [NH3OH]OH, гидроксид гидразония (+2) N2H6(OH)2, хлорид гидразония (+2) N2H6Cl2, хлорид гидроксиламмония NH3OHCl.
Задача 881.
Описать электронное строение молекулы N2 с позиций методов ВС и МО.
Решение:
а) Электронное строение молекулы N2 с позиций метода валентных связей
Атом азота на внешнем электронном слое содержит два спаренных электрона на 2s-подуровне и три неспаренных электрона на 2р-подуровне, по одному на каждой 2р-орбитали. Между двумя атомами азота образуется ковалентная связь тремя электронными парами за счёт спаривания трёх неспаренных электронов каждого атома. Спаренные электроны 2s-орбиталей каждого атома азота не участвуют в образовании связей. Поэтому молекулу N2 в соответствии с теорией валентных связей можно изобразить как имеющую несвязывающие электронные пары у каждого атома азота: — 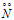 =
=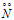 — , но в действительности электронная плотность сосредоточена в основном между атомами. Молекула N2 имеет линейное строение. Так как атомы азота в молекуле N2 одинаковы, то дипольный момент молекулы равен нулю.
— , но в действительности электронная плотность сосредоточена в основном между атомами. Молекула N2 имеет линейное строение. Так как атомы азота в молекуле N2 одинаковы, то дипольный момент молекулы равен нулю.
б) Электронное строение молекулы N2 с позиций метода Молекулярных орбиталей
Электронное строение молекулы N2 можно объяснить с позиций метода молекулярных орбиталей.
С позиций метода МО электронное строение молекулы N2 можно представить так:
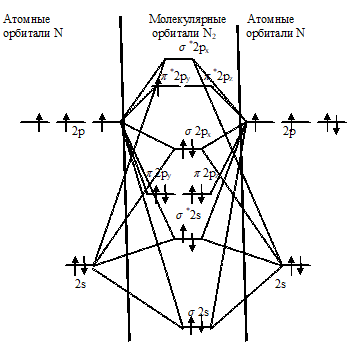
Молекула имеет электронную конфигурацию:
KK(σ[2s)2(σ2s)2(π2ру)2π2рz)2(π2рx)2.
Десять электронов 2s- и 2р-подуровней двух атомов азота заполняют пять молекулярных орбиталей. Расположенные ниже остальныхσ 2s- и σ*2s-орбитали (связывающая и разрыхляющая) из-за компенсации своих энергетических вкладов практически ничего не вносят в энергию образования молекулы N2. Заполнение трёх последующих связывающих орбиталей соответствует образованию σ2р- и двух π2р-связей. Суммарная энергия тройной связи в молекуле N2 очень велика (941 кДж/моль). Разрыхляющие орбитали π*2рz- и π*2ру, расположены гораздо выше, чем верхняя связывающая σ2рх-орбиталь. Поэтому переход электрона с верхней связывающей орбитали на одну из разрыхляющих орбиталей требует затраты значительной энергии (примерно 100 кДж/моль). По этой причине возбуждение молекулы N2 – трудный (энергоёмкий) процесс. Этим и объясняется высокая химическая инертность молекулы N2. Энергии фотона недостаточно для возбуждения молекулы N2, поэтому азот не имеет цвета во всех состояниях.
В молекуле N2 порядок связи равен разности чисел электронов на связывающих и разрыхляющих орбиталях, делённой на 2:
ω= (6 - 0)/2 = 3.
Отсутствие не спаренных электронов в молекуле N2 придаёт ей диамагнитные свойства (в магнитном поле диамагнитные молекулы приобретают небольшой магнитный момент, направленный против внешнего поля, и поэтому слабо выталкиваются из поля). Итак, с позиций метода ВС можно объяснить линейное строение молекулы N2, отсутствие дипольного момента. Из-за отсутствия электрического дипольного момента между молекулами N2 возникают дисперсионные силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса). По этой же причине у азота малая растворимость в полярных растворителях, например, в воде; очень низкие температуры кипения и плавления. Диамагнитность молекулы N2 можно объяснить только с позиции метода МО – наличие неспаренных электронов на молекулярных орбиталях. Валентность (ковалентность) атомов азота объясняется с позиций метода ВС как равная 3 (число неспаренных электронов атома азота, участвующих в образовании трёх ковалентных связей), то в методе МО вместо понятия «валентность» используется понятие «порядок связи» (в молекуле N2 равный 3). Физические свойства азота (температуры кипения и плавления, цвет, диамагнитность и др.) лучше объясняются с позиций метода МО, равно как и химическая инертность.
Задача 882.
Привести примеры реакций, в которых азот играет роль окислителя, и пример реакции, в которой он является восстановителем.
Решение:
а) Реакции, в которых азот играет роль окислителя:
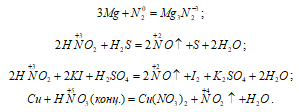
В данных реакциях атом азота понижает свою степень окисления, т. е. проявляет свойства окислителя.
б) Пример реакции, в которой азот проявляет свойства восстановителя:
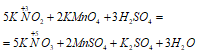
Атом азота в данной реакции повышает свою степень окисления от +3 до +5.

