Определение пространственной структуры комплексных ионов
Задача 750.
Определить пространственную структуру иона [Co(Cl)4]2- учитывая, что значение магнитного момента этого нона соответствует наличию в нем трех неспаренных электронов.
Решение:
На 3d – подуровне иона Cо2+ находятся семь электронов, из них три неспаренных:
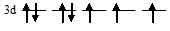
Лиганд слабого поля (Cl) при образовании иона [Co(Cl)4]2- вызывает незначительное расщепление d – подуровня и энергия расщепления столь мала, что d – орбитали заполняются в соответствии с правилом Хунда. в соответствии со схемой:
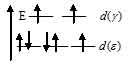
В результате в ионе [Co(Cl)4]2- содержится семь электронов из них три неспаренных, которые и сообщают парамагнитные свойства. Электронная конфигурация иона Cо2+ (...3s23p63d7). Графическая схема заполнения электронами валентных орбиталей, в соответствии с правилом Хунда, будет иметь вид:
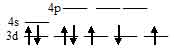
Ион [Co(Cl)4]2- парамагнитен, следовательно, в нём сохраняются три неспаренных электрона на d – подуровне, а акцепторные орбитали (эти орбитали обозначены крестиком) служат одна 4s- и три 4р – орбитали иона Cо2+:
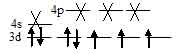
Таким образом, образование иона [Co(Cl)4]2- сопровождается sp3 – гибридизацией АО меди. Пространственная структура этого иона – тетраэдр.
Ответ: Тетраэдр, парамагнитен.
Задача 751.
Ион [Au(Cl)4]- диамагнитен. Определить пространственную структуру этого иона.
Решение:
На 5d – подуровне иона Au3+ находятся восемь электронов, из них один неспаренный:
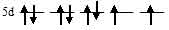
Лиганд слабого поля (Cl) при образовании иона [Au(Cl)4]- вызывает незначительное расщепление d – подуровня и энергия расщепления столь мала, что d – орбитали заполняются в соответствии с правилом Хунда:
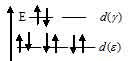
В результате в ионе [Au(Cl)4]- содержится восемь электронов, все они спаренны, что и сообщает диамагнитные свойства. Электронная конфигурация иона Au3+ (...3s23p63d8). Графическая схема заполнения электронами валентных орбиталей иметь вид:
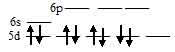
Ион [Au(Cl)4]- диамагнитен, следовательно, в нём сохраняются все спаренные электроны на d – подуровне, а акцепторные орбитали (эти орбитали обозначены крестиком) служат одна 6s-, две 6р и одна 5d – орбитали иона Au3+:
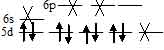
Таким образом, образование иона [Au(Cl)4]- сопровождается dsp2 – гибридизацией АО меди. Пространственная структура этого иона – плоский квадрат.
Ответ: Плоский квадрат, диамагнитен.
Задача 752.
Парамагнетизм иона [Mn(CN)6]4- определяется единственным неспаренным электроном. Определить тип гибридизаций АО иона Mn2+.
Решение:
Электронная конфигурация иона Mn2+ (...3s23p63d5). Графическая схема заполнения электронами валентных орбиталей, в соответствии с правилом Хунда, будет иметь вид:
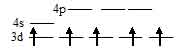
Лиганд сильного поля (СN) при образовании иона [Mn(CN)6]4- вызывает значительное расщепление d – подуровня и энергия расщепления столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов. В этом случае энергетически наиболее выгодно размещение пяти электронов d – орбитали на 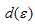 - подуровне и ни одного электрона на
- подуровне и ни одного электрона на 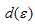 в соответствии со схемой:
в соответствии со схемой:
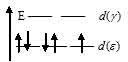
Ион [Mn(CN)6]4- парамагнитен, следовательно, в нём сохраняются четыре спаренных и один неспаренный электронов на d – подуровне, а акцепторные орбитали (эти орбитали обозначены крестиком) служат две 3d-, одна 4s- и три 4р – орбитали иона Mn2+:
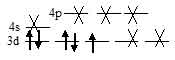
Таким образом, образование иона [Mn(CN)6]4- сопровождается d2sp3 – гибридизацией АО меди. Пространственная структура этого иона – октаэдр.
Ответ: d2sp3 – гибридизация, октаэдр, парамагнитен.
Задача 753.
Ион [Cr(H2O)6]3+ окрашен в зеленый цвет, а нон [Co(H2O)6]3+ - в красный цвет. Указать соотношение длин волн, отвечающих максимумам поглощения света этими нонами:
а) 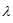 (Сr) >
(Сr) > 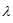 (Сo); б)
(Сo); б) 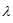 (Сr) =
(Сr) = 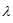 (Сo); в)
(Сo); в) 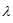 (Сr) <
(Сr) < 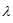 (Сo).
(Сo).
Решение:
Ион [Co(H2O)6]3+ окрашен в зелёный цвет, следовательно, основной цвет видимого спектра - красный. Красному цвету соответствует участок видимого спектра с длиной волны 647 – 710 нм.
Ион [Co(H2O)6]3+ окрашен в красный цвет, следовательно, основной цвет – зелёный, которому соответствует участок видимого спектра с длиной волны 490 – 575 нм.
Таким образом, соотношение длин волн, отвечающих максимумам поглощения света ионами Cr3+ и Co3+ равно: (647 - 710) > (490 - 575); 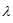 (Сr) >
(Сr) > 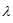 (Сo).
(Сo).
Ответ: а).
Задача 754.
Какие из перечисленных ионов бесцветны:
а) [CuCl2]-; б) [CuCl4]2-; в) [ZnCl4]2-; г) [FeCl4]2-; д) [Cu(NH3)4]+; е) [Zn(NH3)4]2+?
Потому что: 1) в этих ионах центральный атом проявляет высшую степень окисленности; 2) в этих ионах центральный атом не проявляет высшей степени окисленности; 3) в этих нонах центральный ион имеет завершенную 3d - оболочку; 4) в этих нонах центральный нон имеет незавершенную 3d - оболочку.
Решение:
а) [CuCl2]-. Ион меди (I) имеет электронную конфигурацию (...3s23p63d10). Все 3d - орбитали заполнены, и переход электронов с 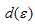 - на
- на 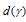 - подуровень не возможен, поэтому ион Cu+ бесцветен.
- подуровень не возможен, поэтому ион Cu+ бесцветен.
б) [CuCl4]2. Ион меди (II) имеет электронную конфигурацию (...3s23p63d9). Следовательно, на верхнем энергетическом уровне имеется одна вакансия, т.е. имеется место для электрона. Поэтому возможен переход электрона с 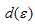 - на
- на 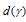 - подуровень, что и определяет окраску иона Cu2+.
- подуровень, что и определяет окраску иона Cu2+.
в) [ZnCl4]2-. Ион цинка Zn2+ имеет электронную конфигурацию (...3s23p63d10). Все 3d - орбитали заполнены, и переход электронов с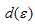 на
на 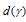 - подуровень не возможен, поэтому ион Zn2+ бесцветен.
- подуровень не возможен, поэтому ион Zn2+ бесцветен.
г) [FeCl4]2-. Ион железа (II) имеет электронную конфигурацию (...3s23p63d6). Следовательно, на верхнем энергетическом уровне имеются ваканси, т.е. имеется место для электронов. Поэтому возможен переход электронов с 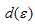 на
на 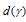 - подуровень, что и определяет окраску иона Fe2+.
- подуровень, что и определяет окраску иона Fe2+.
д) [Cu(NH3)4]+. Ион меди (II) имеет электронную конфигурацию (...3s23p63d9). Следовательно, на верхнем энергетическом уровне имеется одна вакансия, т.е. имеется место для электрона. Поэтому возможен переход электрона с 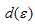 на
на 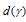 - подуровень, что и определяет окраску иона Cu2+.
- подуровень, что и определяет окраску иона Cu2+.
е) [Zn(NH3)4]2+. Ион цинка Zn2+ имеет электронную конфигурацию (...3s23p63d10). Все 3d - орбитали заполнены, и переход электронов с 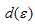 на
на 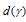 - подуровень не возможен, поэтому ион Zn2+ бесцветен.
- подуровень не возможен, поэтому ион Zn2+ бесцветен.
Ответ: а3; в3; д3; е3.

