Объяснение свойств комплексных ионов построением схем распределения электронов по d-орбиталям центрального атома
Магнитные свойства комплексных ионов
Задача 739.
Изобразить схему распределения электронов по 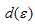 и
и 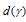 - орбиталям центрального атома в октаэдрическом комплексе [Cr(CN)6]3-. Указать магнитные свойства этого комплекса.
- орбиталям центрального атома в октаэдрическом комплексе [Cr(CN)6]3-. Указать магнитные свойства этого комплекса.
Решение:
На 3d – подуровне иона Cr3+ находятся три неспаренных электрона:
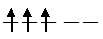
При образовании иона [Cr(CN)6]3- вследствие влияния сильного поля (ион CN-) энергия расщепления d – подуровня будет столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов. В этом случае энергетически наиболее выгодно размещение всех трёх электронов на 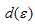 - подуровне в соответствии со схемой:
- подуровне в соответствии со схемой:
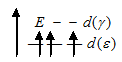
В результате в ионе [Cr(CN)6]3- все электроны оказываются неспаренными, а сам ион - парамагнитен.
Задача 740.
Какими магнитными свойствами обладают ионы: a) [Fe(CN)6]3-;
б) [Fe(CN)6]2-.
Решение:
a) [Fe(CN)6]3-. На 3d – подуровне иона Fe3+ находятся пять электронов, которые, согласно правилу Хунда, неспаренные: 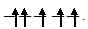 . При образовании иона [Fe(CN)6]3-, вследствие влияния лиганда сильного поля (CN-) энергия расщепления d – подуровня будет столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически более выгодно размещение всех пяти d – электронов на
. При образовании иона [Fe(CN)6]3-, вследствие влияния лиганда сильного поля (CN-) энергия расщепления d – подуровня будет столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически более выгодно размещение всех пяти d – электронов на 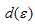 - подуровне в соответствии со схемой:
- подуровне в соответствии со схемой:
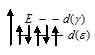
В результате в ионе[Fe(CN)6]3- четыре электрона оказываются спаренными, один электрон (пятый по счёту) – неспаренный. Поэтому данный комплексный ион парамагнитен (парамагнит).
б) [Fe(CN)6]2-. На 3d – подуровне иона Fe3+ находятся пять электронов, которые, согласно правилу Хунда, неспаренные: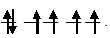 При образовании иона [Fe(CN)6]2-, вследствие влияния лиганда сильного поля (CN-) энергия расщепления d – подуровня будет столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически более выгодно размещение всех шести d – электронов на
При образовании иона [Fe(CN)6]2-, вследствие влияния лиганда сильного поля (CN-) энергия расщепления d – подуровня будет столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически более выгодно размещение всех шести d – электронов на 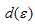 подуровне в соответствии со схемой:
подуровне в соответствии со схемой:
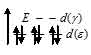
В результате в ионе [Fe(CN)6]2- все шесть электронов оказываются спаренными. Поэтому данный комплексный ион диамагнитен (диамагнит).
Ответ: а) Парамагнитен; б) диамагнитен.
Определение окраски комплексных ионов
Задача 741.
Объяснить, почему соединения меди(I) не окрашены, а соединения меди (II) - окрашены.
Решение:
Ион меди Cu+ имеет электронную конфигурацию (… 3d10). Все 3d – орбитали заполнены, и переход электронов с 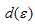 на
на 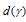 подуровень невозможен. Что можно представить в виде схемы:
подуровень невозможен. Что можно представить в виде схемы:

Ионы меди Cu2+ имеет электронную конфигурацию (… 3d9). Следовательно, на верхнем энергетическом подуровне имеется вакансия. Переход электронов с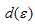 на
на 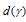 подуровень при поглощении кванта света и определяет окраску соединений меди (II). Что можно представить в виде схемы:
подуровень при поглощении кванта света и определяет окраску соединений меди (II). Что можно представить в виде схемы:
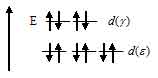
Задача 742.
Для комплексного нона [Cu(NH3)4]2+ максимум поглощения видимого света соответствует длине волны 304 нм, а для иона [Cu(H2O)4]2+ - длине волны 365 нм. Вычислить энергию расщепления d-подуровня в этих комплексных ионах. Как изменяется сила поля лиганда при переходе от NH3 к Н2O?
Решение:
а) Для расчета используем формулу:
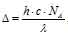
где h – постоянная Планка, 6,6 . 10-34 Дж . с-1; с – скорость света в вакууме, 3 . 10-8 м . с-1; NA – число Авогадро, 6,02 . 1023 моль-1; 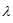 - длина волны. Подставив значения в данную формулу, получим:
- длина волны. Подставив значения в данную формулу, получим:
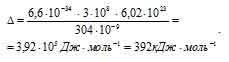
б) Теперь рассчитаем энергию  в ионе [Cu(H2O)4]2+, получим:
в ионе [Cu(H2O)4]2+, получим:
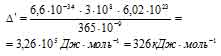
Следовательно, сила поля лиганда от NH3 к Н2О уменьшается, поэтому лиганд Н2О вызывает меньшее расщепление энергии 3d – подуровня.
Ответ: а) 392 кДж . моль; б) 326 кДж . моль.
Задача 743.
Какова окраска соединений марганца (III) в водных растворах, если для иона [Mn(H2O)6]3+  = 250,5 кДж . моль? Какой длине волны соответствует максимум поглощения видимого света этим ионом?
= 250,5 кДж . моль? Какой длине волны соответствует максимум поглощения видимого света этим ионом?
Решение:
Для расчета используем формулу:
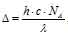
где h – постоянная Планка, 6,6 . 10-34 Дж . с-1; с – скорость света в вакууме, 3 . 10-8 м . с-1; NA – число Авогадро, 6,02 . 1023 моль-1; 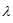 длина волны. Подставив значения в данную формулу, получим:
длина волны. Подставив значения в данную формулу, получим:
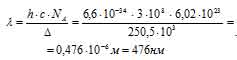
Следовательно, ион [Mn(H2O)6]3+ поглощает свет в голубой части спектра, а соединения марганца (III) в водных растворах окрашены в оранжевый (дополнительный к голубому) цвет.
Ответ: Оранжевый 476 нм.
Задача 744.
Для иона [Rh(H2O)6]3+  = 321,6 кДж.моль-1. Определить окраску этого нона и положение максимума поглощения.
= 321,6 кДж.моль-1. Определить окраску этого нона и положение максимума поглощения.
Решение:
Для расчета используем формулу:
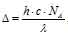
где h – постоянная Планка, 6,6 . 10-34 Дж . с-1; с – скорость света в вакууме, 3 . 10-8 м . с-1; NA – число Авогадро, 6,02 . 1023 моль-1; 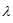 длина волны. Подставив значения в данную формулу, получим:
длина волны. Подставив значения в данную формулу, получим:
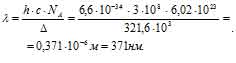
Следовательно, ион [Rh(H2O)6]3+ поглощает свет в невидимой части спектра, а соединения родия (III) в водных растворах будут бесцветны.
Ответ: Бесцветный 371 нм.

