Вычисление ЭДС элемента состоящего из электродов металлов, погруженных в растворы солей этих металлов
Задача 658.
Э. д. с. элемента, состоящего из медного и свинцового электродов, погруженных в 1 М растворы солей этих металлов, равна 0,47 В. Изменится ли э. д. с., если взять 0,001 М растворы? Ответ обосновать.
Решение:
E(Pb2+/Pb) = -0,13B; E(Cu2+/Cu) = +0,34B.
ЭДС элемента определяется как разница потенциалов катода и анода:
ЭДС = Е(катод) - Е(анод) =
= +034 - (-0,13) = +0,47В.
Уравнения полуреакций восстановительного процессов данного гальванического элемента:
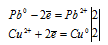
Рассчитаем значения потенциалов, используя уравнение Нернста

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
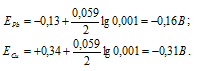
Теперь рассчитаем ЭДС при концентрации ионов металлов 0,001М, получим:
ЭДС = +0,31 - (-0,16) = +0,47B.
Таким образом, ЭДС гальванического элемента при равных концентрациях ионов свинца и меди не изменяется.
Ответ: нет не изменяется.
Задача: 659.
Можно ли составить такой гальванический элемент, во внешней цепи которого электроны перемещались бы от электрода с более положительным стандартным потенциалом к электроду с более отрицательным стандартным потенциалом? Дать объяснение.
Решение:
E(Ni2+/Ni) = -0,25B; E(Co2+/Co) = -0,28B.
Действительно, можно составить такой гальванический элемент, во внешней цепи которого электроны бы перемещались от электрода с более положительным значением стандартного потенциала к электроду с более отрицательным значением стандартного потенциала. Если при этом электрод с более положительным потенциалом погрузить в разбавленный раствор его соли, а более отрицательный электрод – в 1 М раствор его соли. Например, составим гальванический элемент из кобальтового электрода, погружённого в 1 М раствор соли Co(NO3)2 и никелевого электрода, погружённого в 0,001 М раствор Ni(NO3)2.
Рассчитаем значения потенциалов, используя уравнение Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
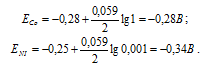
Теперь рассчитаем ЭДС, получим:
ЭДС = +0,28 - (0,34) = +0,62 B.
Схема гальванического элемента:
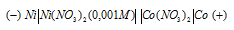
Так как ECo > ENi, то электроны во внешней цепи будут перемещаться от никеля к кобальту. Никель будет растворяться.
Ответ: можно.
Задача 660.
Гальванический элемент составлен из стандартного цинкового электрода и хромового электрода, погруженного в раствор, содержащий ноны Сг3+. При какой концентрации ионов Сг3+ э.д.с. этого элемента будет равна нулю?
Решение:
E(Zn2+/Zn) = -0,76B; E(Co2+/Co) = -0,74B.
Для того чтобы ЭДС гальванического элемента была равна нулю, необходимо чтобы кон-центрационный электродный потенциал хрома оказался равным -0,76В.
Концентрацию ионов хрома, необходимую для получения электродного потенциала хрома равного -0,76В, вычислим, используя уравнение Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
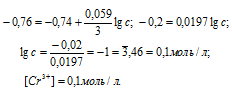
Ответ: [Co2+] = 0,1 моль/л.
Задача 661.
Какие процессы происходят на электродах гальванического элемента 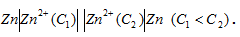 . В каком направлении перемещаются электроны во внешней цепи?
. В каком направлении перемещаются электроны во внешней цепи?
Решение:
Электронные потенциалы рассчитываются по уравнению Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
Чем меньше численное значение логарифма, тем больше получается число. Поэтому при С1 < C2 значения электродных потенциалов будут иметь соотношение  C1 >
C1 >  C2. Поскольку
C2. Поскольку  C1 >
C1 >  C2, то на электроде Zn2+/Zn(C2) будет происходить восстановление, т.е. он будет служить катодом и на нём протекает реакция восстановления:
C2, то на электроде Zn2+/Zn(C2) будет происходить восстановление, т.е. он будет служить катодом и на нём протекает реакция восстановления:
Zn2+ + 2 = Zn0
= Zn0
На электроде Zn2+/Zn(C1) будет протекать процесс окисления:
Zn0 - 2 = Zn2+,
= Zn2+,
т.е. этот электрод будет являться анодом.
Поскольку  C1 >
C1 >  C2, то электроны будут перемещаться от отрицательного полюса к положительному, т. е. в направлении от электрода с меньшим значением концентрации ионов цинка (С1) к электроду с большим значением концентрации ионов цинка (С2).
C2, то электроны будут перемещаться от отрицательного полюса к положительному, т. е. в направлении от электрода с меньшим значением концентрации ионов цинка (С1) к электроду с большим значением концентрации ионов цинка (С2).

