Вычисление потенциала водородного электрода, погруженного в чистую воду и раствор с определенным рН
Задача 655.
Вычислить потенциал водородного электрода, погруженного: в чистую воду в раствор с рН = 3,5; в раствор с рН = 10,7.
Решение:
Стандартный электродный потенциал водородного электрода при нормальных условиях и концентрации ионов
водорода 1 моль/л (рН = 0), условно принимается 0,00В.
Если рН раствора изменять, т.е. изменять концентрацию ионов водорода в растворе, то потенциал водородного электрода тоже будет изменяться. Потенциал водородного электрода при различных значениях рН раствора можно определить из уравнения Нернста:
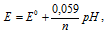
Используя это уравнение определим потенциал водородного электрода, погружённого а) в чистую воду; б) в раствор с рН = 3,5; в) в раствор с рН = 10,7:
а) В чистой воде рН = 7, получим:
Еа) = 0,059 . (-7) = -0,41В ;
б) В растворе с рН = 3,5, получим:
Еб) = 0,059 . (-3,5) = -0,21В ;
в) В растворе с рН = 10,7, получим:
Ев)= 0,059 . (-10,7) = -0,63В.
Ответ: а) -0,41В; б) -0,21В; в) -0,63В.
Задача 656.
Потенциал водородного электрода в некотором водном растворе равен -118 мВ. Вычислить активность ионов Н+ в этом растворе.
Решение:
Величина потенциала водородного электрода определяется по уравнению Нернста:
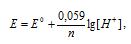
где Е0 – стандартный электродный потенциал водорода; n – число электронов, принимающих участие в процессе; [H+] – концентрация ионов водорода.
Из которого вытекает выражение водородного электрода:
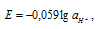
где 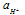 - активность ионов водорода.
- активность ионов водорода.
Подставляя значения по условию задачи, рассчитаем активность ионов водорода, получим:
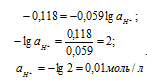
Ответ: 0,01 моль/л.
Задача 657.
Вычислить потенциал свинцового электрода в насыщенном растворе PbBr2, если [Br-] = 1 молы/л, а ПР(PbBr2) = 9,1 . 10-6.
Решение:
E0(Pb2+/Pb) = 0,13 B.
Для расчета потенциала используем уравнение Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
Поскольку концентрация [Br-] = 1 молы/л, а ПР(PbBr2) = 9,1 . 10-6, то концентрация ионов Рв2+ равна:
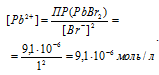
Теперь, подставив значения в уравнение, получим:
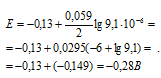
Ответ: -0,28 В.

