Составление схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом — анодом
Задача 650.
Составить схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом — анодом. Написать уравнения реакций, происходящих при работе этих элементов, и вычислить значения стандартных Э. Д.С.
Решение:
а) Гальванический элемент, в котором медь служит катодом.
Схема гальванического элемента:
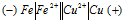
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки – границу раздела двух жидких фаз – пористую перегородку (или соедини-тельную трубку, обычно, заполненную раствором электролита). Железо имеет меньший потенциал (-0,44В) и является анодом, на котором протекает окислительный процесс:
Fe0 - 2 = Fe2+
= Fe2+
Медь, потенциал которой +0,34 В, - катод, т. е. электрод, на котором протекает восстановительный процесс:
Cu2+ + 2 Cu0
Cu0
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим:
Fe0 + Cu2+ = Fe2+ + Cu0
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
E1 =  Cu -
Cu -  Fe;
Fe;
E1 = -44 - (+33) = -0,78B.
б) Гальванический элемент, в котором медь служит катодом.
Схема гальванического элемента:
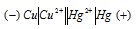
Медь имеет меньший потенциал (+0,34В) и является анодом, на котором протекает окислительный процесс:
Cu0 + 2  = Cu2+
= Cu2+
Ртуть, потенциал которой +0,86В, - катод, т.е. электрод, на котором протекает восстановительный процесс:
Hg2+ - 2  + Hg0
+ Hg0
Рассчитаем ЭДС данного элемента:
E2 = Hg -
Hg -  Cu;
Cu;
E2 + +o,86 - (+0,34) = 0,52B.
Задача 651.
В каком направлении будут перемещаться электроны во внешней цепи следующих гальванических элементов:
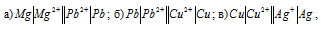
если все растворы электролитов одномолярные? Какой металл будет растворяться в каждом из этих случаев?
Решение:
а)
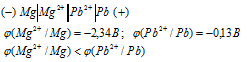
Поскольку потенциал магния меньше потенциала свинца, то магниевый электрод будет служить отрицательным полюсом (электродом) и электроны будут перемещаться во внешней цепи от магниевого электрода к свинцовому электроду. Следовательно, магний в данном случае будет растворяться.
б)
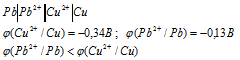
Поскольку потенциал свинца меньше потенциала меди, то свинцовый электрод будет служить отрицательным полюсом (электродом) и электроны будут перемещаться во внешней цепи от свинцового электрода к медному электроду. Следовательно, свинец в данном элементе будет растворяться.
в)

Поскольку потенциал меди меньше потенциала серебра, то медный электрод будет служить отрицательным полюсом (электродом) и электроны будут перемещаться во внешней цепи от медного электрода к серебряному электроду. Следовательно, медь в данном элементе будет растворяться.
Ответ: а) от Mg к Pb; б) от Pb к Cu; в) от Cu к Ag.

