Решение задач с использованием уравнения Нернста (Nernst)
Решение задач по химии с использованием уравнениея Нернста
Задание 246.
Потенциал серебряного электрода в растворе АgNO3 составил 95% от значения его стандартного электронного потенциала. Чему равна концентрация ионов Аg+ (моль/л). Ответ: 0,20 моль/л.
Решение:
Электродный потенциал металла (Е)зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Используя уравнение Нернста, получим выражение для расчета концентрации ионов Ag+ в растворе:
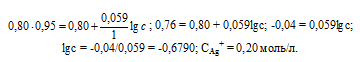
Ответ: 0,20 моль/л.
Задание 247.
Составьте схему, напишите электронные уравнения электродных процессов, и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Сd2+] = 0,8 моль/л, а [Сu2+] = 0,01 моль/л. Ответ: 0,68 В.
Решение:
Схема данного гальванического элемента:
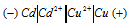
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки - границу раздела двух жидких фаз - пористую перегородку (или соединительную трубку, заполненную раствором электролита). Кадмий имеет меньший потенциал (—0,403 В) и является анодом, на котором протекает окислительный процесс:
Cd0 - 2 = Cd2+ (1)
= Cd2+ (1)
Медь, потенциал которой +0,34 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Cu2+ + 2 = Cu0 (2)
= Cu0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Cd0 + Cu2+ = Cd2+ + Cu0
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
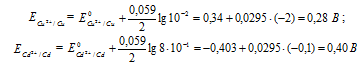
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе 1 молы/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
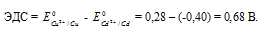
Ответ: 0,68 В.
Задание 248.
Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом - анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
Решение:
а) Схема гальванического элемента, в котором медь является катодом:
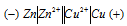
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки - границу раздела двух жидких фаз - пористую перегородку (или соединительную трубку, заполненную раствором электролита). Цинк имеет меньший потенциал (-0,763 В) и является анодом, на котором протекает окислительный процесс:
Zn0 - 2  = Zn2+ (1)
= Zn2+ (1)
Медь, потенциал которой +0,34 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Cu2+ + 2  = Сu0 (2)
= Сu0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Zn0 + Cu2+ = Zn2+ + Cu0
б) Схема гальванического элемента, в котором медь является анодом:
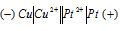
Медь имеет меньший потенциал (+0,34 В) и является анодом, на котором протекает окислительный процесс:
Cu0 - 2  = Cu2+ (1)
= Cu2+ (1)
Платина, потенциал которой +1,19 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Pt2+ + 2  = Pt0 (2)
= Pt0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Сu0 + Pt2+ = Cu2+ + Pt0
Задание 249.
При какой концентрации ионов Сu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 2,98 . 10-12 моль/л..
Решение:
Определим концентрацию ионов Cu2+, при которой потенциал медного электрода равен 0,00 В, получим:
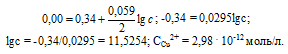
Ответ: 2,98 . 10-12 моль/л.
Задание 250.
Какой гальванический элемент называют концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй в 0,1 н. растворы AgNO3. Ответ: 0,059 В.
Решение:
Гальванический элемент, работа которого основана на различных концентрациях ионов металла у катода и у анода, называется концентрационным. Обычно катод и анод сделаны из одного и того же металла, опущенных в растворы своей соли разной концентрации. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы серебряных электродов при разных концентрациях ионов серебра Ag+, получим:
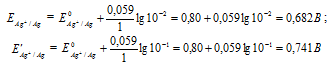
Схема гальванического элемента будет иметь вид:
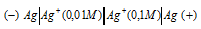
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
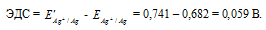
Ответ: 0,059 В.

