Расчет потенциала водородного электрода при различных рН раствора
Задача 666.
Чему равен потенциал водородного электрода при рН = 10: а) -0,59В; б) -0,30В; в) 0,30В; г) 0,59В?
Решение:
Электродный потенциал, зависящий от концентрации ионов Н+ (или ОН-), т.е. от рН раствора определяется выражением: E = -0,059pH, получим: E = -0,059 . 10 = 0,59В.
Ответ: г).
Задача 667.
На сколько изменится потенциал цинкового электрода, если раствор соли цинка, в который он погружен, разбавить в 10 раз: а) возрастет на 59 мВ; 6) уменьшится на 59 мВ; в) возрастет на 30 мВ; г) уменьшится на 30 мВ?
Решение:
Стандартный потенциал цинкового электрода равен -0,76 В. Для расчета потенциала используем уравнение Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе. Электрохимическая система цинкового электрода имеет вид:
Zn2+ = 2 = Zn0
= Zn0
Таким образом, в процессе окисления участвует два электрона, и при этом, используя уравнение Нернста, и то, что по условию задачи концентрация ионов цинка уменьшена в 10 раз, получим:
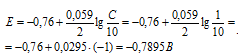
Находим изменение потенциала цинкового электрода при разбавлении раствора соли в 10 раз: Е0 – Е = -0,76 – (-0,7895) = 0,0295 0,03 В или 30 мВ.
Ответ: г).
Задача 668.
Водородный электрод погружен в раствор с рН = 0. На сколько изменится потенциал электрода, если раствор нейтрализовать до рН = 7:
а) увеличится на 59 мВ; б) увеличится на 0,41 В; в) уменьшится на 0,41 В; г) уменьшится на 59 мВ?
Решение:
Стандартный электродный потенциал водорода считается равным нулю. Электродный потенциал, зависящий от концентрации ионов Н+ (или ОН-), т.е. от рН раствора определяется выражением: Е = -0,059 рН.
Тогда
E1 = -0,059 . 0,00 = 0,00 B
Теперь определим значение электродного потенциала при рН = 7, получим:
E2 = -0,059 . 7 = 0,41 B.
Таким образом, произошло уменьшение электродного потенциала при нейтрализации раствора на 0,41 В [0 – (-0,41) = 0,41].
Ответ: в).
Задача 669.
Имеется гальванический элемент 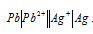 . Как изменится его Э. Д. С., если в раствор, содержащий ионы свинца, добавить сероводород: а) увеличится; б) уменьшится; в) останется неизменной?
. Как изменится его Э. Д. С., если в раствор, содержащий ионы свинца, добавить сероводород: а) увеличится; б) уменьшится; в) останется неизменной?
Решение:
Свинец имеет меньший потенциал (-0,13 В) и является анодом, на котором протекает окислительный процесс:
Pb0 - 2 = Pb2+
= Pb2+
Серебро, потенциал которого +0,80 , - катод, т.е. электрод, на котором протекает восстановительный процесс:
Ag+ + 1 = Ag0
= Ag0
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, и при этом катодное уравнения умножив на 2, получим:
Pb0 + 2Ag+ = Pb2+ + 2Ag0
Для определения ЭДС гальванического элемента необходимо из потенциала катода вы-честь потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
E1 = E(Ag0) - E(Pb0) =
= 0,80 - (-0,13) = 0,93 B.
Если в раствор, содержащий ионы свинца добавить раствор H2S, т.е. дополнительно в систему будет введены ионы водорода Н+, то тогда выражение для определения потенциала свинцового электрода будет иметь вид:
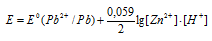
Таким образом, численное значение члена  станет больше, чем 0,059lg[Zn2+]/2 и тогда потенциал свинцового электрода станет ещё более электроотрицательней, чем был до добавления H2S. ЭДС гальванического элемента соответственно увеличится с увеличением электроотрицательности анода.
станет больше, чем 0,059lg[Zn2+]/2 и тогда потенциал свинцового электрода станет ещё более электроотрицательней, чем был до добавления H2S. ЭДС гальванического элемента соответственно увеличится с увеличением электроотрицательности анода.
Ответ: а).
Задача 670.
Каким из предлагаемых способов можно увеличить э.д.с. гальванического элемента: 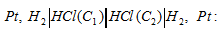
а) уменьшить концентрацию НСI у катода; б) уменьшить концентрацию НСI у анода; в) увеличить концентрацию НСI у катода; г) увеличить концентрацию НСI у анода?
Решение:
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = E(катод) - Е(анод)
Электронные потенциалы рассчитываются по уравнению Нернста:

Е0 – стандартный электродный потенциал электрода; n – число электронов, принимающих участие в процессе; с – концентрация ионов электрода в растворе.
Чем меньше численное значение логарифма, тем больше получается значение члена 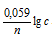 . Поэтому при уменьшении концентрации C2 у анода значения электродного потенциала анода соответственно, станет более электроотрицательней, что приведёт к увеличению значения ЭДС гальванического элемента. При увеличении концентрации C1, соответственно, уменьшится численное значение члена
. Поэтому при уменьшении концентрации C2 у анода значения электродного потенциала анода соответственно, станет более электроотрицательней, что приведёт к увеличению значения ЭДС гальванического элемента. При увеличении концентрации C1, соответственно, уменьшится численное значение члена  , т.е. катод станет менее электроотрицательней, чем был до того, и ЭДС гальванического элемента увеличится (так как увеличится разность между катодом и анодом [E(катод) - Е(анод)].
, т.е. катод станет менее электроотрицательней, чем был до того, и ЭДС гальванического элемента увеличится (так как увеличится разность между катодом и анодом [E(катод) - Е(анод)].
Ответ: б); в).
Задача 671.
Гальванический элемент составлен из двух водородных электродов, из которых один стандартный. В какой из перечисленных растворов следует погрузить другой электрод для получения наибольшей э. д. с.: а) 0,1 М НСl; 6) 0,1 М СН3СООН; в) 0,1 М Н3PO4?
Решение:
Стандартный электродный потенциал водорода принят равным 0,00 В. Так как значение стандартного водородного электрода будет иметь более положительное число, чем потенциал водородного электрода 0,1М растворах кислот, то он будет являться катодом, а кислотные электроды – анодами.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т. е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = E(катод) - Е(анод)
Электронные потенциалы рассчитываются по уравнению Нернста:

Е0 – стандартный электродный потенциал электрода; n – число электронов, принимающих участие в процессе; с – концентрация ионов электрода в растворе.
Чем меньше численное значение логарифма, тем больше получается значение члена 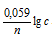 . Так как СН3СООН является более слабым электролитом, нежели HCl и Н3РО4, то при равных концентрациях раствор в нём будет содержать меньше число ионов водорода (с будет иметь меньшее численное значение). Член
. Так как СН3СООН является более слабым электролитом, нежели HCl и Н3РО4, то при равных концентрациях раствор в нём будет содержать меньше число ионов водорода (с будет иметь меньшее численное значение). Член 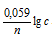 , следовательно, будет иметь большее численное значение, т.е. анод в растворе СН3СООН будет более электро-отрицательный, чем в растворах HCl и Н3РО4, потому что увеличится разница между значениями потенциалов катода и анода [E(катод) - Е(анод)], ЭДС гальванического элемента увеличится.
, следовательно, будет иметь большее численное значение, т.е. анод в растворе СН3СООН будет более электро-отрицательный, чем в растворах HCl и Н3РО4, потому что увеличится разница между значениями потенциалов катода и анода [E(катод) - Е(анод)], ЭДС гальванического элемента увеличится.

