Вычисление соотношения между растворимостями разных солей
Задача 577.
Произведения растворимости NiC2O4 и Na3AlF6 одинаковы (4 . 10-10), Какое соотношение между растворимостями (моль/л) этих солей правильно: а) S(NiC2O4) > S(Na3AlF6); б) S(NiC2O4) = S(Na3AlF6); в) S(NiC2O4) < S(Na3AlF6).
Решение:
а) Обозначим искомую растворимость NiC2O4 через S (моль/л). Тогда в насыщенном растворе NiC2O4 содержится S (моль/л) ионов Ni2+ и S (моль/л) ионов C2O42-.
Отсюда
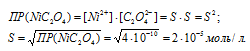
б) Обозначим искомую растворимость Na3AlF6 через S' (моль/л). Тогда в насыщенном растворе Na3AlF6 содержится 3S' (моль/л) ионов Na+ и S' (моль/л) ионов AlF63-.
Отсюда
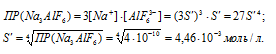
Таким образом, 2 . 10-5 , 4,46 . 10-3; S < S'; S(NiC2O4) < S(Na3AlF6).
Ответ: в).
Задача 578.
Произведения растворимости AgBrO3 и Ag2SO4 равны соответственно 5,5 . 10-5 и 2 . 10-2. Укажите правильное соотношение между растворимостями (S, моль/л) этих солей: а) S(AgBrO3) < s(Ag2SO4); 6) S(AgBrO3) = s(Ag2SO4); в) S(AgBrO3) > s(Ag2SO4);.
Решение:
а) Обозначим искомую растворимость AgBrO3 через S (моль/л). Тогда в насыщенном растворе AgBrO3 содержится S (моль/л) ионов Ag+ и S (моль/л) ионов BrO3-.
Отсюда
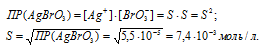
б) Обозначим искомую растворимость Ag2SO4 через S'(моль/л). Тогда в насыщенном растворе Ag2SO4 содержится 2S' (моль/л) ионов Ag+ и S' (моль/л) ионов SO42-.
Отсюда
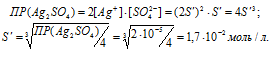
Следовательно, S < S'. так как 7,4 . 10-3 < 1,7 . 10-2, т.е. S(AgBrO3) < s(Ag2SO4).
Ответ: а).
Задача 579.
Как изменится растворимость CaF2 в 0,1 М растворе KNO3 по сравнению с его растворимостью в воде: а) возрастет; 6) уменьшится; в) останется неизменной?
Решение:
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путём введения другого электролита, содержащего тот же ион) произведение концентрации ионов электролита становится больше ПР. При этом равновесие между твёрдой фазой и раствором смещается в сторону образования осадка. Таким образом, условием образования осадка является превышение произведения концентрации ионов малорастворимого электролита над его произведением растворимости. При этом происходит уменьшение растворимости данного малорастворимого электролита.
Напротив, если в насыщенном растворе электролита уменьшить концентрацию одного из ионов (например, связав его каким-либо другим ионом), произведение концентрации ионов электролита будет меньше значения ПР, раствор станет ненасыщенным, и равновесие между жидкой фазой и осадком сместится в сторону растворения его, т.е. растворимость данного малорастворимого электролита возрастёт. Так при прибавлении к раствору CaF2 0,1 м раствора KNO3 в осадок будет переходить эквивалентное число ионов Ca2+ и F-. Тогда концентрации ионов кальция и фтора в насыщенном растворе электролита уменьшится соответственно на 0,05 и 0,1 моль/л. Тогда можно рассчитать численное значение уменьшение произведения концентрации ионов по сравнению произведением растворимости электролита, получим:
[Ca2+] . [F-]2 = 0,05 . (0,1)2 = 5 . 10-4.
Таким образом, произведение концентрации ионов электролита уменьшится по сравнению с ПР на 5 . 10-4 молей, т.е. [Ca2+] . [F-]2 < ПР(СaF2), а растворимость электролита возрастёт.
Ответ: а).

