Решение задач по химии на расчет нормальности раствора кислоты при осаждении сульфата бария
Задача 447.
Для полного осаждения BaSO4 из 100 г 15%-ного (по массе) раствора BaCl2 потребовалось 14,4 мл H2SO4. Найти нормальность раствора H2SO4.
Решение:
М(BaCl2) = 208,274 г/моль.
Уравнение реакции имеет вид:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Рассчитаем массу серной кислоты, необходимую для взаимодействия с 15 г BaCl2 из пропорции:
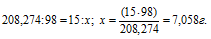
Теперь рассчитаем массу серной кислоты, которая содержится в 1000 мл из пропорции:
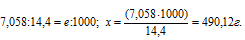
Определим молярную массу эквивалента H2SO4 из соотношения:
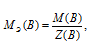 где
где
МЭ(В) - молярная масса эквивалента кислоты, г/моль; М(В) - молярная масса кислоты; Z(B) - эквивалентное число; равно числу ионов H+, H2SO4 → 2.
Отсюда
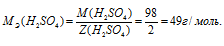
Для расчета нормальности раствора используем формулу:
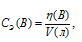 где
где
СЭ(В) – молярная концентрация эквивалента вещества В; V(мл) – объём раствора; n(B) – количество эквивалентов вещества В.
Тогда
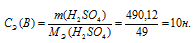
Ответ: 10 Н.
Задача 448.
В 500 г воды растворено при нагревании 300 г NH4Cl. Какая масса NH4Cl выделится из раствора при охлаждении его до 50°С, если растворимость NH4Cl при этой температуре равна 50 г в 100 г воды?
Решение:
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе, т.е. массой вещества, растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора. При охлаждении раствора до 50 °С на каждые 100 г воды в растворе останется 50 г NH4Cl, а излишки соли выпадут в осадок, при этом образуется насыщенный раствор соли NH4Cl.
Рассчитаем массу NH4Cl оставшуюся в растворе после охлаждения из пропорции:
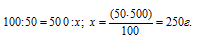
Рассчитаем массу NH4Cl выпавшей после охлаждения в осадок: 300 – 250 = 50 г.
Ответ: 50 г.
Задача 449.
Растворимость хлората калия при 70 °С равна 30,2 г, а при 30 °С — 10,1 г в 100 г воды. Сколько граммов хлората калия выделится из 70 г насыщенного при 70 °С раствора, если его охладить до 30 °С?
Решение:
Содержание хлората калия при 70 °С в 70 г раствора его найдём из пропорции:
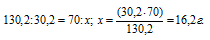
Содержание хлората калия в 70 г раствора при 30 °С находим из пропорции:
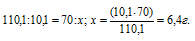
Таким образом, при охлаждении раствора в осадок выпало 9,8 г хлората калия (16,2 – 6,4 = 9,8).
Ответ: 9,8 г.
Задача 450.
Коэффициент растворимости сульфата меди при 30 °С равен 25 г на 100 г воды. Будет ли при этой температуре 18% раствор соли насыщенным?
Решение:
Коэффициент растворимости – это масса вещества, растворяющегося при данных условиях в 100 г воды с образованием насыщенного раствора.
Рассчитаем массовую долю насыщенного раствора сульфата меди при 30 °С по формуле:

где
w(%) - массовая доля растворённого вещества; m(в-ва) - масса растворённого вещества; m(р-ра) - масса раствора.
Тогда
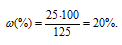
Это значит, что 20%-ный раствор сульфата меди является насыщенным, а 18%-ный – не будет насыщенным.
Ответ: Нет.

